
编者按:
抗生素能抑制细菌生长或杀灭细菌,在治疗细菌感染性疾病上做出了突出贡献。然而,抗生素的过度使用却引发了耐药性问题。并且,近年来的研究发现抗生素严重破坏肠道菌群的平衡。那么,抗生素究竟会如何“伤害”肠菌呢?这种伤害是短暂的还是持久的?
今天,我们共同关注抗生素。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
抗生素的发现是医学史上的一次突破。虽然它们可以拯救生命,但它们也有“黑暗面”。今年早些时候发表在《柳叶刀》上的一项研究显示1,在 2019 年,耐药性微生物造成了超过一百万人的死亡。
此外,越来越多的研究发现,即使是进行短疗程的抗生素治疗也能改变肠道菌群的构成。而且,这种影响可能非常巨大,有些人在经过抗生素治疗后,其微生物组的组成与 ICU 患者的微生物组相似。
而在治疗中存活下来的微生物往往携带耐药基因,这有可能使病原体获得躲避最佳药物的能力。
总的来说,圣路易斯华盛顿大学医学院的病理学家和微生物学家 Gautam Dantas 说,这些发现是一个警告,“每次服用抗菌素都是一场赌博,哪怕这种使用是有根据的。”

Dantas 说,研究抗生素效果的一个棘手方面是,被开抗生素处方的患者的肠道微生物组“由于其他原因已经处于混乱状态”,尤其是住院患者。在这种情况下,可能很难将抗生素对微生物组的影响与疾病相关的影响区分开来。
因此,包括 Dantas 和他的同事、传染病专家 Jennie Kwon 等人在内的研究人员一直在找寻健康的志愿者。
“很多人在开抗生素处方时,总认为这种治疗的危害很小,特别是如果只是口服几天药片的话,”Kwon 说,“但我们的问题是,这是真的吗?当你给一个健康个体短期施用抗生素时,会对肠道微生物组造成破坏吗?”
为回答这一问题,研究团队招募了 20 名健康志愿者并将他们分成四组,每组接受不同的抗生素或抗生素组合,试验一共为期五天。
选择的药物为左氧氟沙星、阿奇霉素、头孢泊肟,以及阿奇霉素和头孢泊肟的组合,这些药物通常用于治疗社区获得性肺炎患者,尽管有时可能是病毒性肺炎。
研究人员分别在进行抗生素治疗之前、期间和治疗结束后收集了志愿者粪便样本(最后一个样本在治疗后六个月采集),以进行分析。从这些样本中,研究人员绘制了肠道细菌多样性的变化情况以及耐药基因的拷贝数的波动情况。
研究团队发现,服用抗生素后,总的微生物物种丰度和可培养物种丰度立即下降。
圣路易斯华盛顿大学医学院的博士生 Winston Anthony 指出,对于大多数志愿者来说,这些测量值在两个月后回到了基线值,但现存的物种仍然发生了变化。他是该团队近期发表在《Cell Reports》期刊上的这篇论文2的共同作者,他说,这意味着抗生素“正在从根本上重构微生物组”。
在三名被分配到不同的治疗组健康志愿者中,他们的肠道微生物组受到的干扰尤甚。即使在结束试验六个月后,他们的微生物组多样性仍在减少。Kwon 说:“他们的肠道菌群变得更像 ICU 的患者,而不是健康个体。”不过,她也指出,他们和其他参与者都感觉良好。
阿姆斯特丹大学的传染病专家 W. Joost Wiersinga 曾单独研究过抗生素对健康个体的影响3,他表示,这项新研究“为抗生素对健康成年人的肠道菌群有重大不利影响提供了新证据。”
事实上,在 Wiersinga 和同事在 2018 年进行的研究中,在服用广谱抗生素一周以后,健康志愿者的肠道微生物组多样性开始下降,链球菌和乳酸杆菌出现过度生长。尽管随着时间的推移,这些细菌种群变得不那么丰富,但在服用抗生素后的 31 个月,参与者的微生物组组成仍与最初的状态不同。
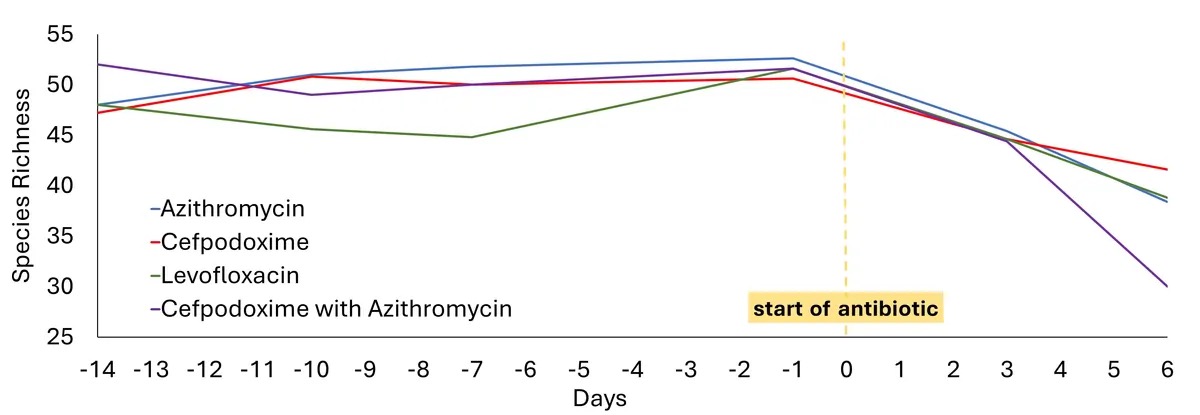
图1. 抗生素对健康志愿者肠道菌群的扰动。
除了诱导微生物组的组成变化,抗生素似乎还促进了耐药基因的流行。 在 Anthony 等人的研究中,治疗后 6 个月采集的样本发现,使用四种抗生素中的三种(除了左氧氟沙星)进行处理的组别中,受试者携带的抗生素耐药基因的相对数量更高了——作者称这种变化为“抗生素疤痕”。
没有参与此次研究的巴塞罗那瓦尔德希伯伦大学附属医院的消化系统研究员 Francisco Guarner 认为,这种耐药性基因的长期增加值得关注。
他将肠道微生物组描述为一个受到抗生素干扰的生态系统。 “当你服用抗生素时,系统中的一些细菌会消失,而一些细菌会过度生长,因此,平衡发生了变化。在这种新的平衡中,将会得到对抗生素更具耐药性的细菌。”
携带抗生素耐药性基因的肠道细菌可能会带来多种威胁。当肠道细菌和病原体混合时,耐药性基因可以发生转移4,从而使病原体获得耐药性。最近发表的一项研究发现5,耐药性肠道共生菌甚至可以降解肠道中的抗生素,从而保护病原体免受药物的影响。
在进一步的研究中,Kwon 正在观察,是不是社区中的某些健康个体可以作为耐药性基因的储存库,把耐药性基因传递给其他人。
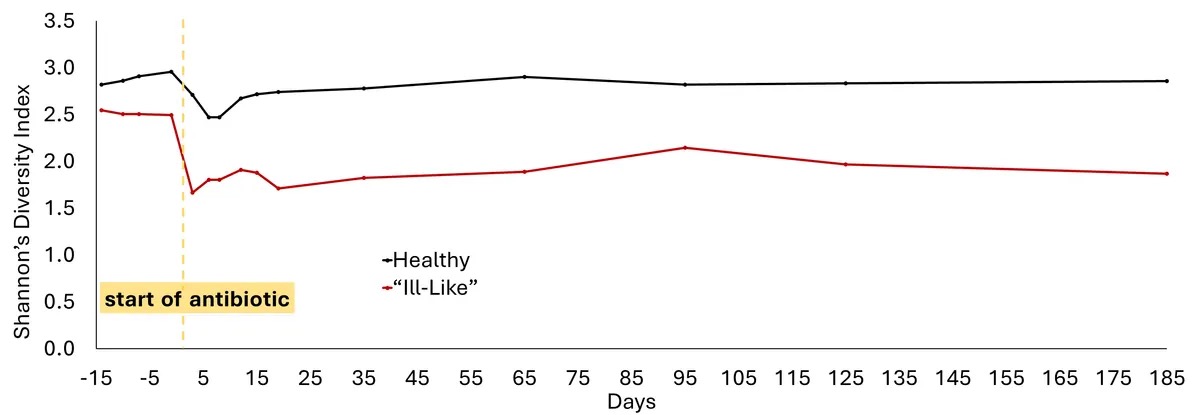
图2. 部分健康志愿者的肠道菌群在接受抗生素治疗后无法完全恢复。
目前尚不清楚为什么有些人的肠道微生物似乎特别容易受到抗生素的破坏。 “个体之间差异很大。” Wiersinga 表示。那么,人们的微生物组能否恢复到初始状态?如果能,需要多长时间?
Anthony 指出,治疗前的微生物组状态可能是其中的一个因素。在他与 Dantas 和 Kwon 合作的研究中,那三名与 ICU 患者更相似的志愿者,初始的物种多样性就偏低。
Anthony 提出了几个假说来解释这种初始差异,包括他们在研究之前可能已经服用过几轮抗生素。Kwon 说,探究对抗生素反应不同的原因,可能有助于改进对它们的使用。未来,需要有更多研究揭示所涉及的微生物组学和代谢组学因素,并确定它们是否具有预测临床价值。
最后,Wiersinga 认为,众多研究结果提醒医生“在开处方前要三思:我的病人真的需要抗生素吗?”
参考文献:
(滑动查看全部)
1. Collaborators A R, Darboe S, Carvalheiro C G, et al. Articles Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis Antimicrobial Resistance Collaborators*[J]. The Lancet, 2022.
2. Anthony W E, Wang B, Sukhum K V, et al. Acute and persistent effects of commonly used antibiotics on the gut microbiome and resistome in healthy adults.
3. Bastiaan W, Haak, Jacqueline M, et al. Long-term impact of oral vancomycin, ciprofloxacin and metronidazole on the gut microbiota in healthy humans.[J]. The Journal of antimicrobial chemotherapy, 2018.
4. Mcinnes R S, Mccallum G E, Lamberte L E, et al. Horizontal transfer of antibiotic resistance genes in the human gut microbiome[J]. Current Opinion in Microbiology, 2020, 53:35-43.
5. Bastiaan W, Haak, Jacqueline M, et al. Long-term impact of oral vancomycin, ciprofloxacin and metronidazole on the gut microbiota in healthy humans.[J]. The Journal of antimicrobial chemotherapy, 2018.
原文链接:
https://www.the-scientist.com/news-opinion/what-happens-to-the-gut-microbiome-after-taking-antibiotics-69970
作者|Sophie Fessl
编译|Dayu
审校|617
编辑|豫小鱼


