随着免疫学、微生物学和合成生物学的发展,当前有许多科学家将目光重新投向了工程菌,希望通过工程菌来开发新的疗法。近期,哥伦比亚大学的研究者在Science杂志上发表研究(查看热心肠日报短科普),开发了一种益生菌引导的CAR-T 细胞平台(ProCAR),用于实体瘤治疗。
今天,我们特别关注该研究,了解研究背后的故事以及该方法的应用前景。希望本文能够为助诸位读者带来一些启发和帮助。
19世纪90年代,内科医生William Coley在得知一些癌症患者经受细菌感染后出现了肿瘤自发消退的情况后,其给癌症患者注射了细菌1。他是最早将免疫系统激活与抗肿瘤反应联系起来的科学家之一,因此他也被称为“免疫疗法之父”。
尽管在临床上取得了一些成功,但由于安全性问题和放射治疗的兴起导致这些神奇的细菌药物(当时被称为Coley毒素)逐渐被淘汰。
在过去的几十年里,免疫学、微生物学和合成生物学取得的进展重新燃起了人们对使用工程菌治疗癌症的兴趣2。在一篇发表在Science杂志上的论文中,研究人员设计了一种工程化益生菌,并将其定植在肿瘤中,以引导工程化T细胞到达癌症部位3。
该研究创造的新平台不仅表明工程细菌可以帮助现有的免疫疗法进入难以治疗的实体肿瘤,而且凸显了活体生物药更为广泛的治疗潜力。
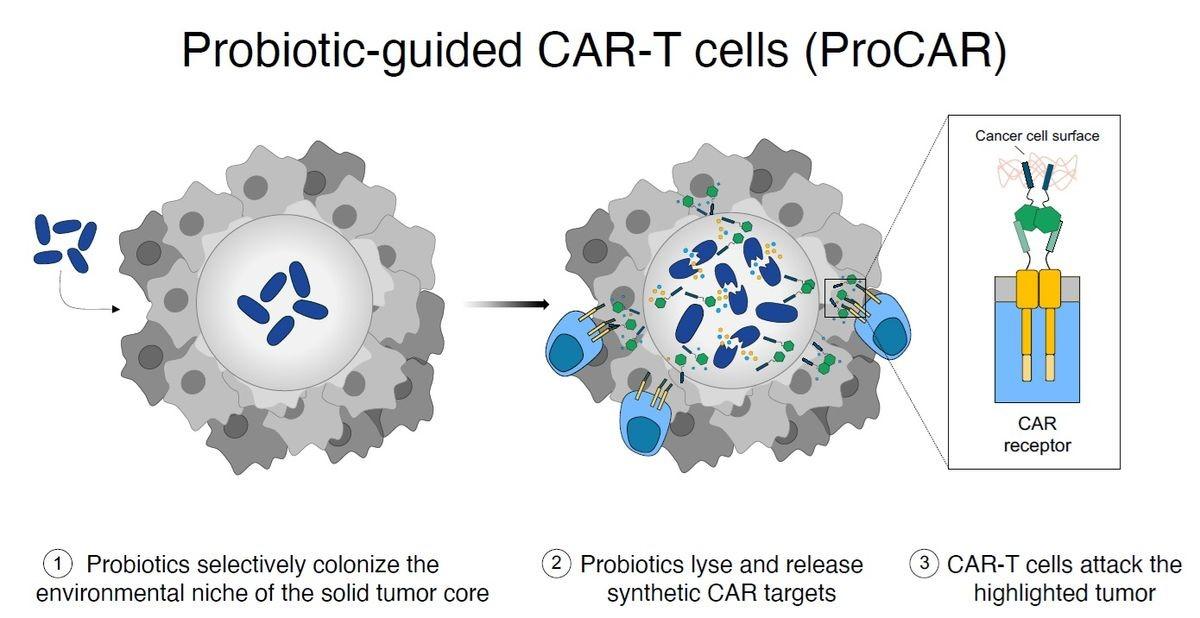
肿瘤微环境是一个不友好的生态系统。“不过细菌不在乎这些,换言之,细菌实际上是在人体内寻找一个远离免疫系统的生存环境。”这项研究的作者、哥伦比亚大学合成生物学家Tal Danino认为。
实体瘤的核心部位缺氧、极少受到监控,是细菌的理想栖息地。然而,一些细菌菌株仍会栖息在健康的器官中。因此,研究人员需要探索修改细菌基因组的方法,以降低其毒力和毒性,避免损伤健康器官。虽然减毒细菌在小鼠和人体中都被证明是更安全的,但研究人员发现其在肿瘤中的定植效果不佳,当然,也无法让肿瘤消退4-5。
因此,为了改善药物对肿瘤的靶向性和特异性,研究人员正在探索合成生物学解决方案。
Danino与Jeff Hasty和Omar Din合作开发了细菌中的微小基因回路(tiny genetic circuits)。这种回路使得细菌一旦达到种群密度阈值或群体感应密度阈值,就会触发裂解效应,从而释放出基因编码的“货物”6。如果细菌过少,未能达到密度阈值,就无法触发裂解效应,于是细菌会继续进行下一轮生长,直至达到裂解的密度。
“这是一个不完美的系统,而这正是它的魅力所在,”Danino团队的研究生、论文共同作者Rosa Vincent说,“这是一种循环传递机制。”
在研发出这一系统后,Danino开始对使用这种振荡基因回路解决生物医学难题产生了兴趣,于是他转向了细菌癌症疗法。细菌对肿瘤微环境有趋向性,因此他专注于对细菌进行工程改造,使其一旦进入肿瘤就能开始诊断或产生治疗效果,就像特洛伊木马一样7-8。
斯坦福大学的生物工程师Rogelio Hernández-López认为(没有参与这项研究):“利用细菌标记特定位置的想法非常有前景,而且克服了抗原异质性的难题。”
难以使用嵌合抗原受体(CAR)T细胞等抗原靶向疗法治疗实体瘤的原因之一在于肿瘤表面的抗原很少是癌细胞特异性的9。此外,不同患者的肿瘤相关抗原也不尽相同,而且癌细胞会发生突变,从而逃避靶向治疗,这使得临床医生不得不追捕一个不断发生变化的目标。
“我开始思考,如果没有好的靶点,我们怎么能为实体瘤构建出优秀的CAR呢?”Vincent说道。这种好奇心让她开始研究Danino用于治疗癌症的工程菌。
研究人员改造了益生菌菌株大肠杆菌Nissle 1917,该菌株应用了Danino的群体感应裂解回路。一旦细菌达到群体数量阈值,它们就会释放出能够粘附在肿瘤上的合成抗原。
具体而言,就是研究人员将绿色荧光蛋白(GFP)与胎盘生长因子蛋白的肝素结合域(HBD)融合在一起10。有黏性的HBD会锚定在肿瘤环境中普遍存在的胶原蛋白和多糖上,从而将GFP标记到肿瘤上。
尽管这些分子也存在于健康组织中,但它们在肿瘤中含量很高。“我们完全依赖于细菌对这些肿瘤的特异性。”Vincent指出。
大多数FDA批准的CAR-T细胞疗法都以肿瘤抗原分化簇19(CD19)为靶点,但Vincent设计的CAR以其合成的GFP抗原为靶点。“我们将肿瘤涂成绿色,T细胞就识别绿色,”Vincent说,“CAR的优点在于它们是模块化的,所以其实你可以用任何东西替换抗原结合域。”Vincent说。
研究人员观察到,在使用不同的人类癌细胞系对上述益生菌CAR系统进行体外测试时,与缺乏GFP标志物或受体的系统相比,益生菌CAR系统的特异性和细胞毒性都有所提高。
体外测试结束后,他们的系统就可以“整装出发”了!
在益生菌CAR系统进行首次体内测试时,研究人员选择了携带人类癌细胞来源的皮下肿瘤的免疫缺陷小鼠。在将工程菌直接注入肿瘤后,他们等待了48小时,以便让GFP标记定量调节释放,然后再注入工程CAR11。工程益生菌CAR系统抑制了肿瘤生长,而对肿瘤进行的流式细胞分析结果提供了T细胞活化增强的证据。
研究人员还发现,部分系统会产生部分反应:与工程CAR同时给药的空载细菌仍会在肿瘤部位引发一些T细胞活化。“我最喜欢这个系统的一点是,T细胞对细菌的反应非常强烈,”Vincent说,“这使它们成为真正理想的合作有机体。而且,它们可以释放有效载荷,但它们也具有天然的刺激性,因此它们会让‘较冷的肿瘤’变成‘较热的肿瘤’”。
为了促进CAR T细胞的增殖性和持久性,患者必须首先进行淋巴细胞清除,以杀死循环T细胞12。然而,免疫疗法的长期目标是激活完整的免疫系统,以加强治疗效果。Vincent说:“我们需要内源性免疫系统的帮助,而不是依靠单一抗原来清除整个肿瘤。”
为了在功能正常的免疫系统中测试他们的系统,Vincent和她的同事们向具有免疫能力的小鼠的两侧后腹部植入了小鼠源性肿瘤,然后将工程菌直接注入其中一个肿瘤部位,几天后再进行两轮CAR T治疗(他们引入了额外剂量的CAR T细胞以应对T细胞衰竭)。
令人兴奋的是,研究人员发现不仅治疗部位的肿瘤生长减少,而且未经治疗的部位肿瘤生长也有所减缓。这表明他们的系统能够产生足够的炎症来刺激宿主免疫系统识别额外的肿瘤。
接着,研究人员进行了皮下实验——静脉注射益生菌CAR系统,从而为大型试验做准备。为此,他们将人类癌细胞植入免疫系统较弱的小鼠乳腺脂肪垫中,然后给予益生菌CAR治疗,并对该系统进行了微小的调整:为了进一步诱导CAR T细胞到达肿瘤部位,研究人员对细菌进行了改造,使其释放免疫细胞引诱剂人类趋化因子配体16(CXCL16)13。
这一调整为CAR T细胞沿着浓度梯度向肿瘤移动铺平了道路。添加的趋化因子“货物”为该系统增添了动力,因此优化后的益生菌CAR系统在抑制肿瘤生长的效果方面优于标准益生菌CAR系统。此外,对其他器官的分析显示,细菌和GFP的表达仅限于肿瘤部位。
然而想要将上述系统应用于人体之前,研究人员还需要对工程菌进行基因减毒。在这项研究中,研究人员使用的是大肠杆菌野生型菌株,但小鼠对革兰氏阴性菌毒性的敏感性低于人类14。“因此,实验室现在的主要工作是尝试制造一种可转化的细菌菌株。”Vincent说。
“这是两个不同的工程系统如何互补并协同发挥作用的例子,”Hernández-López说,“Danino多年来一直在开发细菌裂解回路,现在我们看到这一系统能够与其他方法相结合,这真是太棒了。”
当Danino看到细菌时,他看到的是一个多功能平台,既能向肿瘤输送治疗药物,又能与其他方法发生交互。除了重塑肿瘤环境以增强CAR T的疗效外,研究人员还在探索如何利用工程细菌增强正电子发射断层扫描(PET)/磁共振成像(MRI)、聚焦超声,甚至递送载药纳米颗粒15。
“我们真正激动的是建立一个平台,其他人可以利用它来输送他们的荷载物或与他们正在开发的其他方法进行交互。”Danino说道。
“微生物组工程领域正慢慢与工程化T细胞领域接轨,接下来会发生什么令人十分期待。”Hernández-López说道。
参考文献:
(滑动查看全部)
1. Hoption Cann SA, et al. Dr William Coley and tumour regression: a place in history or in the future. Postgrad Med J. 2003;79(938):672-680.
2. Duong MTQ, et al. Bacteria-cancer interactions: bacteria-based cancer therapy. Exp Mol Med. 2019;51:1-15.
3. Vincent RL, et al. Probiotic-guided CAR-T cells for solid tumor targeting. Science. 2023;382(6667):211-218.
4. Low KB, et al. Lipid A mutant Salmonella with suppressed virulence and TNFα induction retain tumor-targeting in vivo. Nat Biotechnol. 1999;17:37-41.
5. Toso JF, et al. Phase I study of the intravenous administration of attenuated Salmonella typhimurium to patients with metastatic melanoma. J Clin Oncol. 2002;20(1):142-152.
6. Din MO, et al. Synchronized cycles of bacterial lysis for in vivo delivery. Nature. 2016;536:81-85.
7. Danino T, et al. Programmable probiotics for detection of cancer in urine. Sci Transl Med. 2015;7(289):289ra84.
8. Chowdhury S, et al. Programmable bacteria induce durable tumor regression and systemic antitumor immunity. Nat Med. 2019;25:1057-1063.
9. Albelda SM. CAR T cell therapy for patients with solid tumors: key lessons to learn and unlearn. Nat Rev Clin Oncol. 2023;21(1):47-66.
10. Martino MM, et al. Growth factors engineered for super-affinity to the extracellular matrix enhance tissue healing. Science. 2014;343(6173):885-888.
11. Gurbatri CR, et al. Engineered probiotics for local tumor delivery of checkpoint-blockade nanobodies. Sci Transl Med. 2020;12(530):eaax0876.
12. Amini L, et al. Preparing for CAR T cell therapy: patient selection, bridging therapies and lymphodepletion. Nat Rev Clin Oncol. 2022;19:342-355.
13. Savage TM, et al. Chemokines expressed by engineered bacteria recruit and orchestrate antitumor immunity. Sci Adv. 2023;9(10):eadc9436.
14. Copeland S, et al. Acute inflammatory response to endotoxin in mice and humans. Clin Diagn Lab Immunol. 2005;12(1):60-67.
15. Gurbatri CR, et al. Engineering bacteria as interactive cancer therapies. Science. 2022;378(6622):858-864.


