
各位观众,大家好,我是来自华中农业大学的陶诗煜。很荣幸受热心肠研究院的邀请,跟大家一起分享交流“基于肠道菌群解析腹泻仔猪肠道损伤修复的机制”。

猪肉是目前世界上人类食用量最大的陆栖动物肉类。我国是世界第一的养猪大国和猪肉消费大国,世界上近一半的猪养在中国,并且我国居民猪肉消费占肉类消费的比例高达62%。因此,养猪业在我国的国民经济、社会稳定和新农村建设中具有非常重要的地位和作用。
而在猪的整个生命周期中,仔猪的健康生长发育是制约养猪生产效率和效益的关键环节,可谓“得仔猪者得天下”。
根据农业农村部统计,断奶前后仔猪腹泻率达30%,死亡率达15%,直接经济损失2400亿元。
以前,通过在仔猪教槽料中添加抗生素是防治仔猪腹泻的主要措施。然而,在全面禁抗的大环境下,寻求新的方式以有效防治仔猪腹泻,是保障我国养猪业健康可持续发展的关键环节与当务之急。

FMT也就是粪便微生物移植,是将健康人的粪便微生物移植到病人肠道内,重塑正常肠道菌群结构的方法。鉴于FMT疗法的良好效果,其已成为复杂肠道疾病的常规治疗手段。
伴随着粪便微生物移植技术在人类医学上的不断完善,其也已辐射至畜牧业。我国畜牧学领域的专家们研究发现:将抗逆性强的从江香猪的粪便微生物移植到商品猪肠道后,可显著降低仔猪早期断奶所致的腹泻发生率。
此外,浙江金华猪的粪便菌液也可显著增加受体仔猪的平均日增重,并降低早期断奶仔猪的腹泻率。FMT同样可以降低仔猪肠道上皮损伤的易感性,并调节肠道微生物区系的色氨酸代谢。
这些研究表明,FMT可以作为防治仔猪腹泻的一项新策略。然而,在FMT治疗过程中,究竟是哪些肠道微生物赋予了良好的治疗功效呢?这是还需要深入探索的问题。

益生菌可以改善肠道菌群结构、调节宿主肠道黏膜免疫和维持肠上皮屏障功能。越来越多的证据表明,用关键益生菌菌株重建肠道菌群是对抗胃肠道疾病的有效策略。
很多益生菌相关的研究登上了顶刊,也逐渐被知名生物企业列为发展规划。

而除了直接与宿主相互作用外,益生菌还能通过分泌活性物质调节宿主的生理功能。细菌分泌的胞外囊泡可以通过运输和递送,调节宿主信号通路和细胞过程的效应分子,来影响宿主的健康。
近年来,益生菌通过分泌胞外囊泡与宿主细胞之间进行交流,逐渐引起了科学界的关注。最近的一项研究表明,Akk菌(Akkermansia muciniphila)分泌的胞外囊泡可调节肠道微生物区系、激活免疫细胞、刺激肠道紧密连接和黏液蛋白表达,从而缓解结肠炎,并提高抗PD-1在结直肠癌治疗中的疗效。
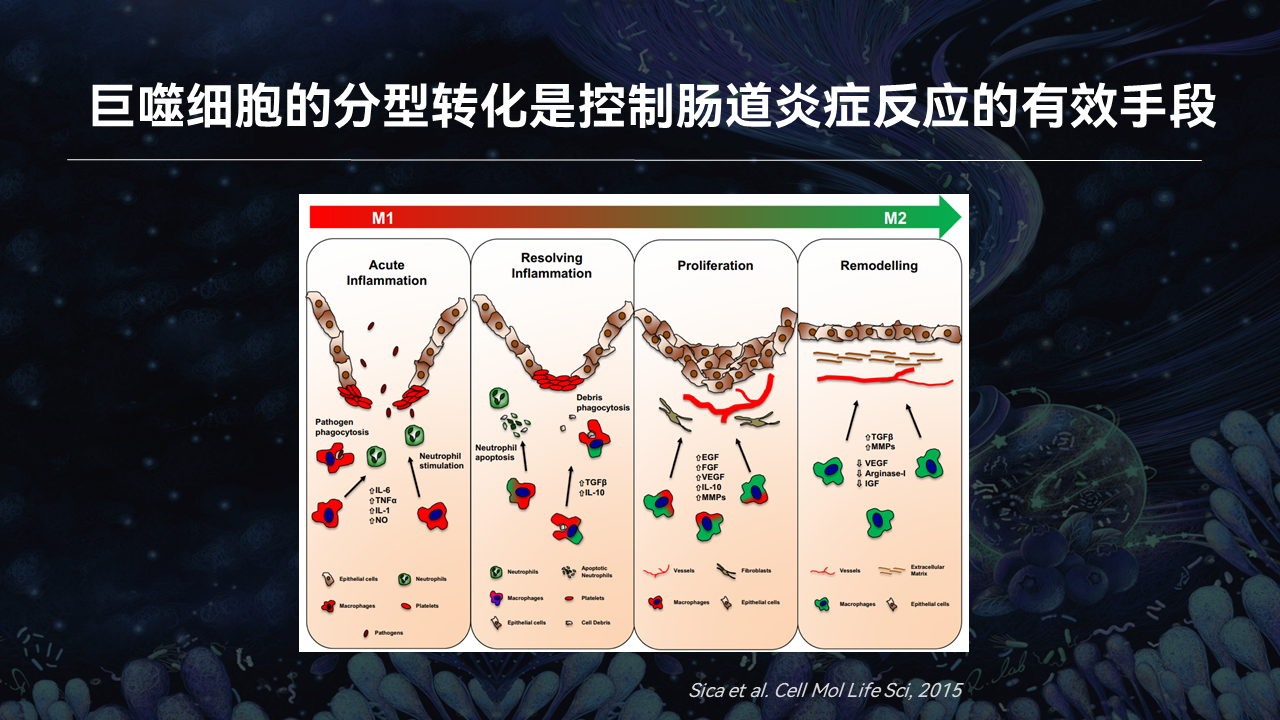
巨噬细胞,作为启动和调控炎症反应的核心细胞,可以产生多种细胞因子,对维持肠道稳态具有重要作用。巨噬细胞在体内会受到局部微环境的诱导,分化成促炎的M1型巨噬细胞和抗炎的M2型巨噬细胞。而M2型巨噬细胞能够通过抑制促炎细胞因子分泌和增加紧密连接蛋白表达,来增强肠道屏障功能。
哺乳动物巨噬细胞通过吞噬作用吸收细菌胞外囊泡,将其内容物送入细胞质,从而影响巨噬细胞的免疫功能。有研究表明,益生菌的胞外囊泡可被巨噬细胞内化,对巨噬细胞发挥炎性可塑性。
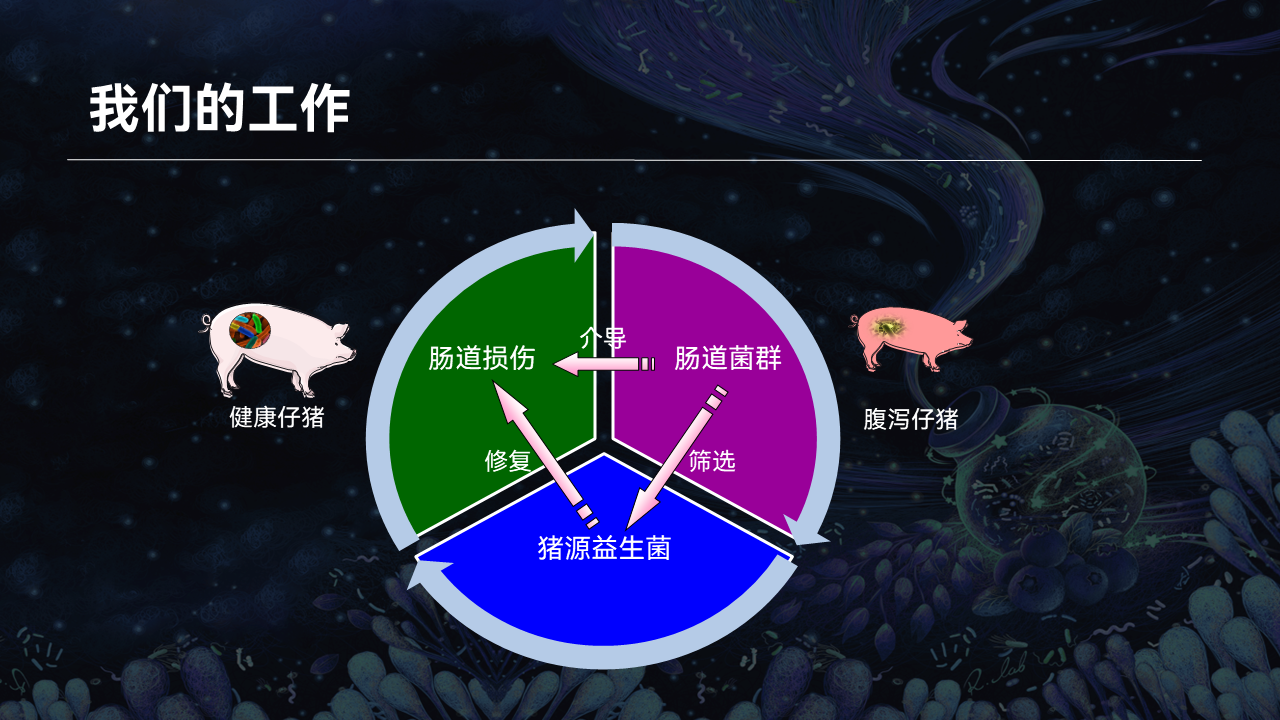
接下来跟大家分享一下我们课题组的一些研究工作:首先,我们揭示了腹泻仔猪的肠道微生物组特征;其次,我们探究了腹泻仔猪肠道炎性损伤的微生物介导机制;最后,通过筛选潜在的猪源益生菌,并解析了益生菌及其胞外囊泡修复腹泻仔猪肠道损伤的机制。
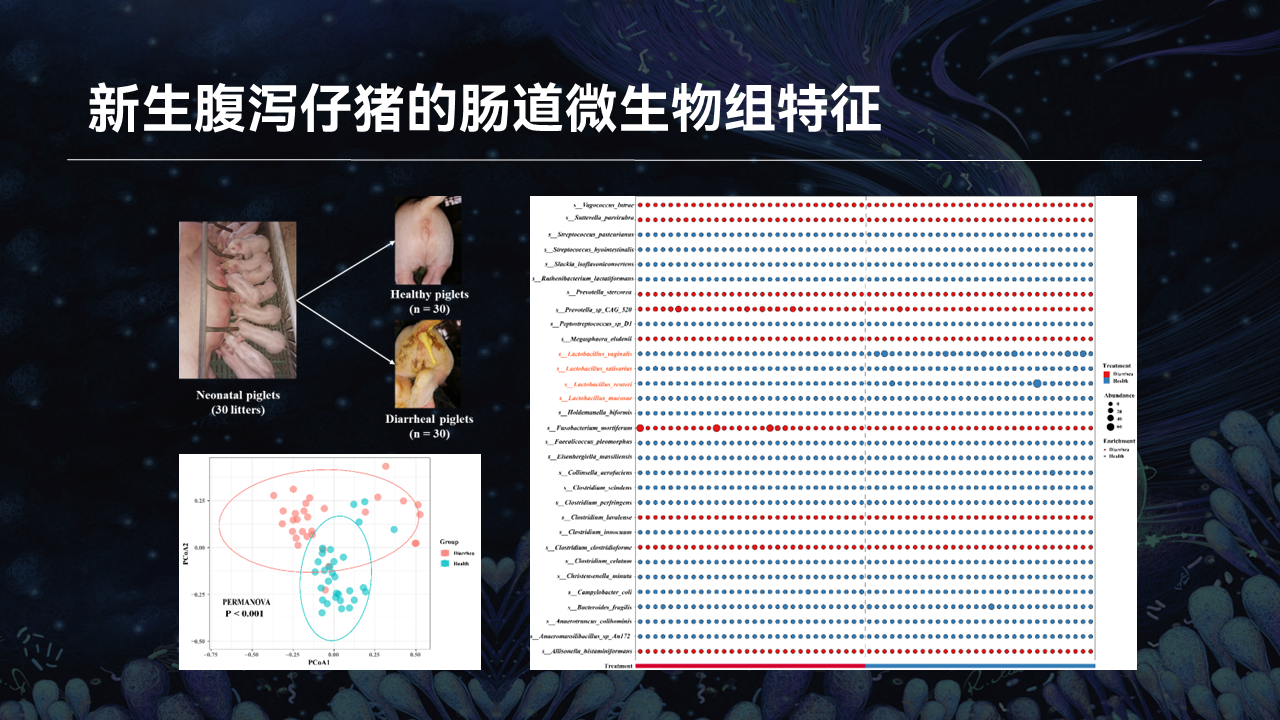
我们首先从新生仔猪入手,在母猪分娩后,共挑选30窝仔猪,每窝挑选1头腹泻仔猪和1头健康仔猪,并采集它们的粪便样品进行宏基因组测序。
生物信息学分析发现,腹泻和健康仔猪的微生物区系结构之间存在着巨大的差异;腹泻仔猪肠道微生物的丰富度降低而多样性升高;乳酸菌和大肠杆菌,分别是健康和腹泻仔猪的优势菌属;两组仔猪的肠道微生物在种水平上同样存在巨大差异,其中有4个乳酸菌种显著富集于健康仔猪。
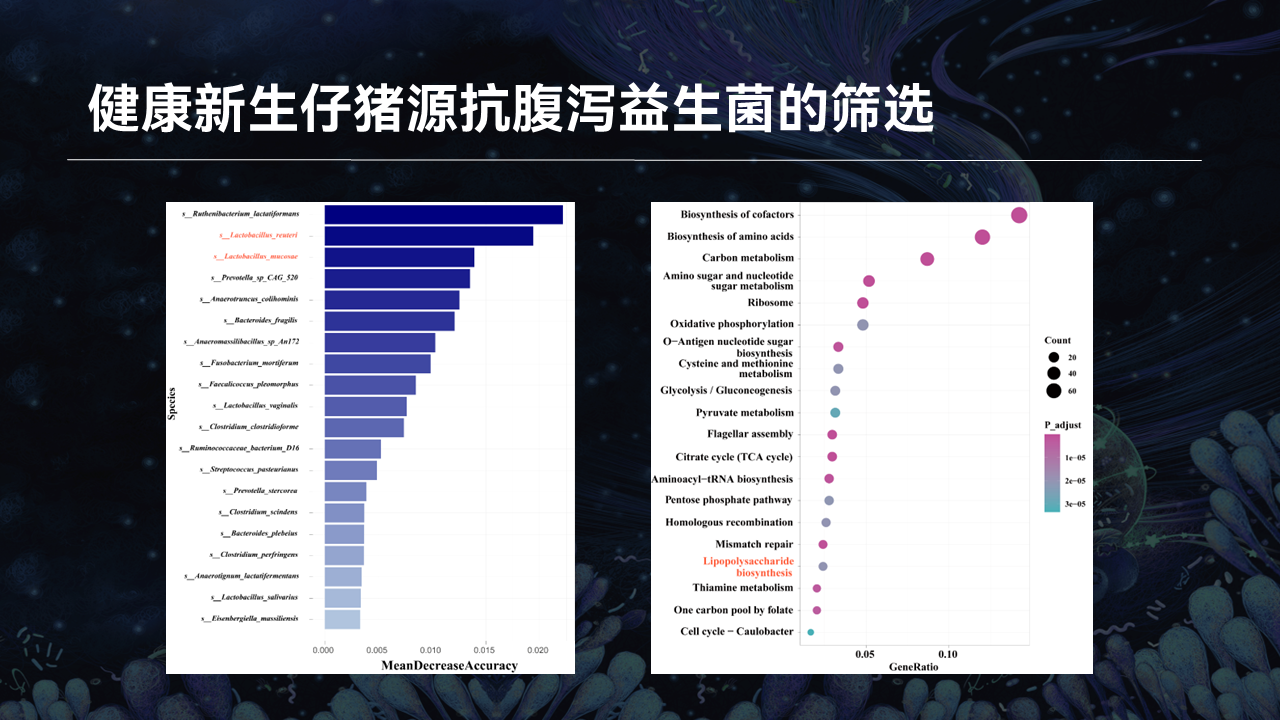
进一步的随机森林机器学习算法结果表明,罗伊氏乳杆菌、黏膜乳杆菌是区分仔猪健康和腹泻的关键菌,提示它们可能在对抗腹泻疾病中起着重要的介导作用。这一随机森林分类模型的准确性通过ROC分析进行了验证,表明我们的模型准确性很高。
脂多糖(LPS)是大肠杆菌产生的一种经典毒力因子,可导致腹泻疾病的发生。我们的KEGG功能分析显示,腹泻新生仔猪的LPS生物合成显著高于健康新生仔猪。并且,在腹泻仔猪中,所有富含LPS生物合成途径的KO都是升高的。
此外,我们通过检测发现,腹泻仔猪粪便中的LPS含量也明显高于健康仔猪。
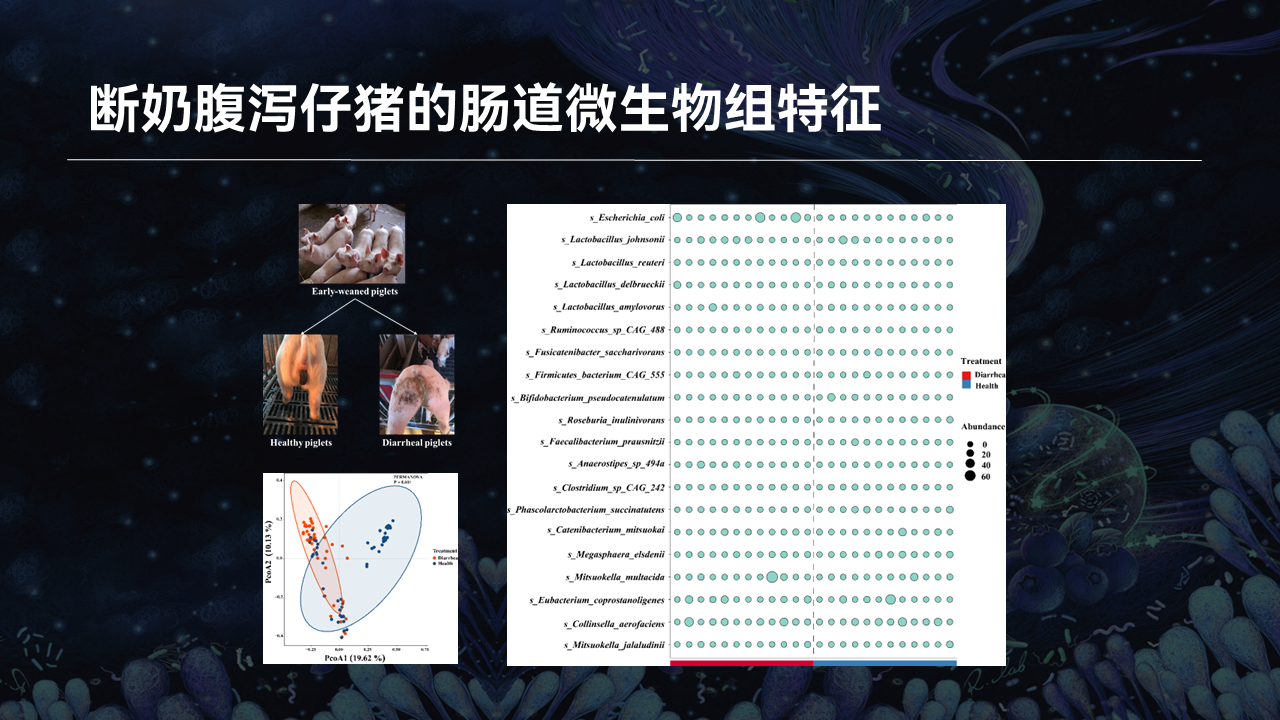
除了新生仔猪外,我们同样对断奶腹泻仔猪的肠道微生物组特征进行了分析。
我们总共挑选了55头健康断奶仔猪和45头腹泻断奶仔猪,并收集了它们的粪便样本。我们对所有的粪便样本进行16S测序分析后,对代表性的样品进行了宏基因组测序分析。
分析后发现,健康和腹泻仔猪的肠道微生物区系结构之间同样存在区别,腹泻仔猪肠道微生物的丰富度和多样性均显著高于健康仔猪。差异分析显示,大肠杆菌在腹泻仔猪显著富集,乳酸菌则是健康仔猪粪便中最主要的优势菌属,其中约氏乳杆菌是所有乳酸菌属中丰度最高的菌种。
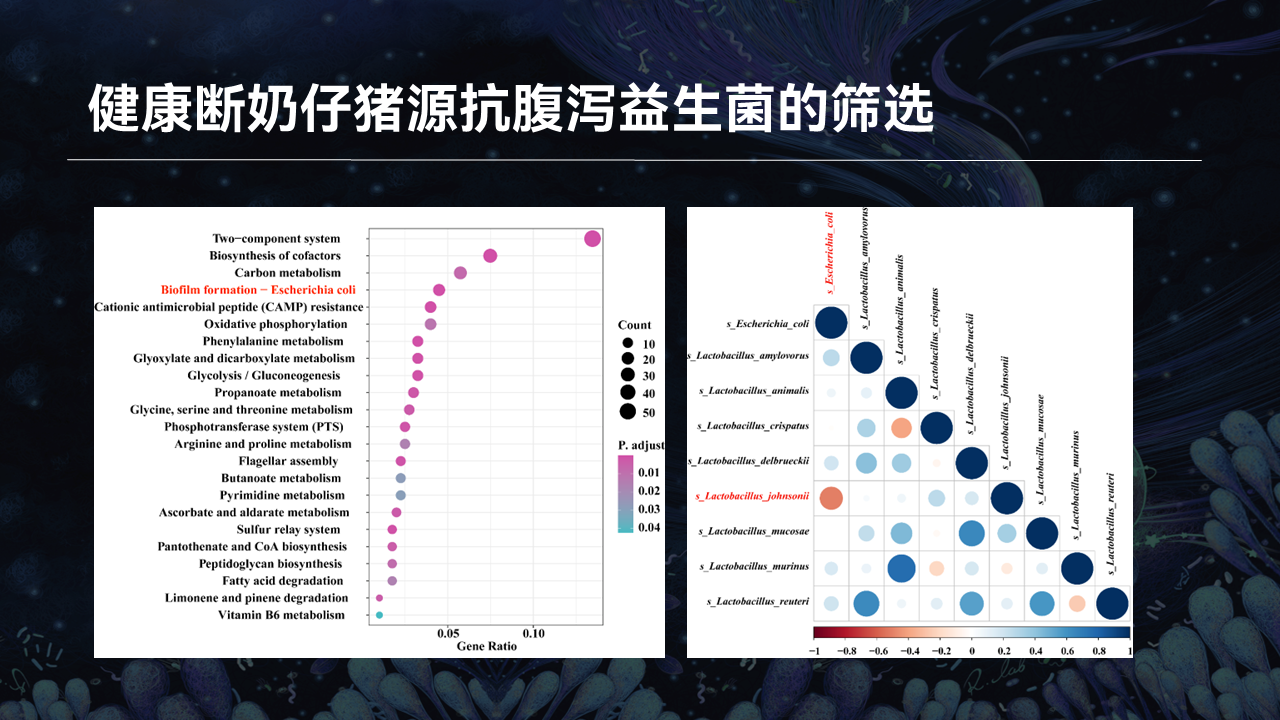
与差异分析结果一致,KEGG功能分析显示,大肠杆菌生物膜形成这一信号通路的富集程度在两组之间存在差别。我们进一步进行了大肠杆菌与不同的乳酸菌种的相关性分析发现,约氏乳杆菌是唯一与大肠杆菌呈强负相关的乳酸菌。
上述这些新生和断奶腹泻仔猪肠道微生物组的特征共同提示,仔猪肠道中潜在致病菌和益生菌丰度的稳态失衡,可能是腹泻疾病的重要危险因素。这些结果也证明了仔猪腹泻疾病与肠道微生物组之间存在相关关系。
除了肠道微生物组紊乱外,腹泻患者还常常伴有肠道炎性损伤,这也是腹泻疾病的典型症状之一。
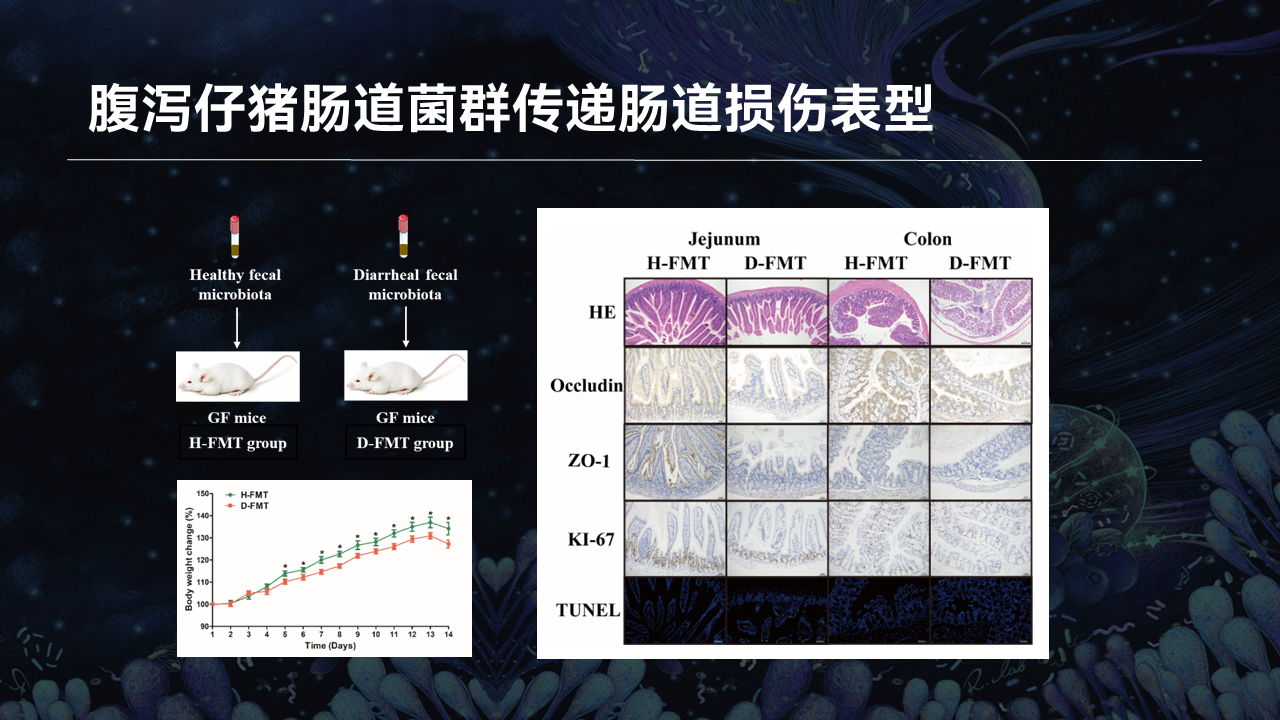
除了具有治疗复杂疾病的潜力外,FMT还有助于提示肠道微生物与宿主疾病表型、组织器官生理功能之间的内在联系。因此,我们使用FMT的方法将健康和腹泻仔猪的粪菌悬液,分别通过灌胃的方式移植给无菌小鼠。
我们发现,腹泻仔猪受体小鼠的生长速率明显低于健康仔猪受体小鼠。与此同时,腹泻仔猪受体小鼠空肠绒毛发育受阻,结肠组织病理学评分升高,空肠和结肠的紧密连接蛋白表达降低,肠上皮细胞凋亡程度增加而增殖能力降低。
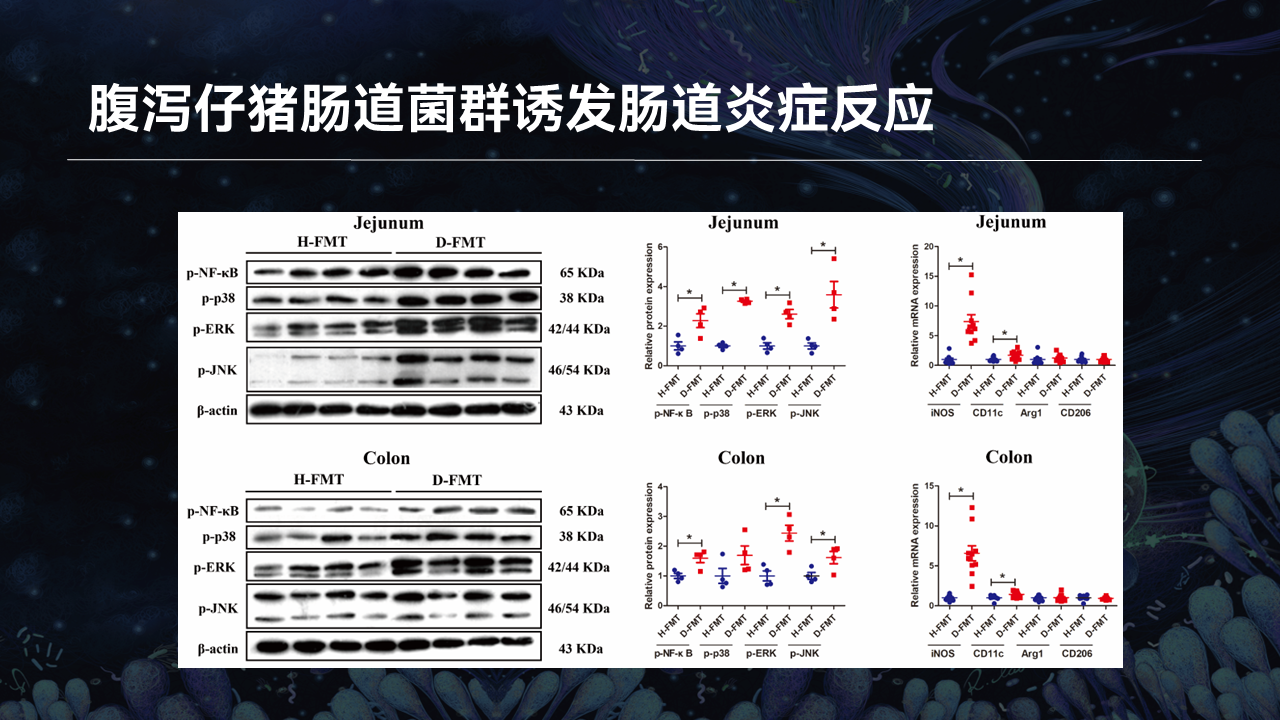
通过检测两组受体小鼠肠道组织促炎信号通路的表达情况,我们发现腹泻仔猪受体小鼠肠道的炎性调节因子NF-κB、MAPK信号通路关键蛋白p38、ERK和JNK的表达均有不同程度的升高。并且促炎的M1型巨噬细胞标志物的基因表达,也在腹泻仔猪受体小鼠肠道显著升高。
这些结果共同表明,腹泻仔猪紊乱的肠道菌群是腹泻疾病继发的生长迟缓和肠道炎症反应的直接原因。这些结果也证明了,腹泻仔猪肠道微生物与肠道炎性损伤之间的因果关系。
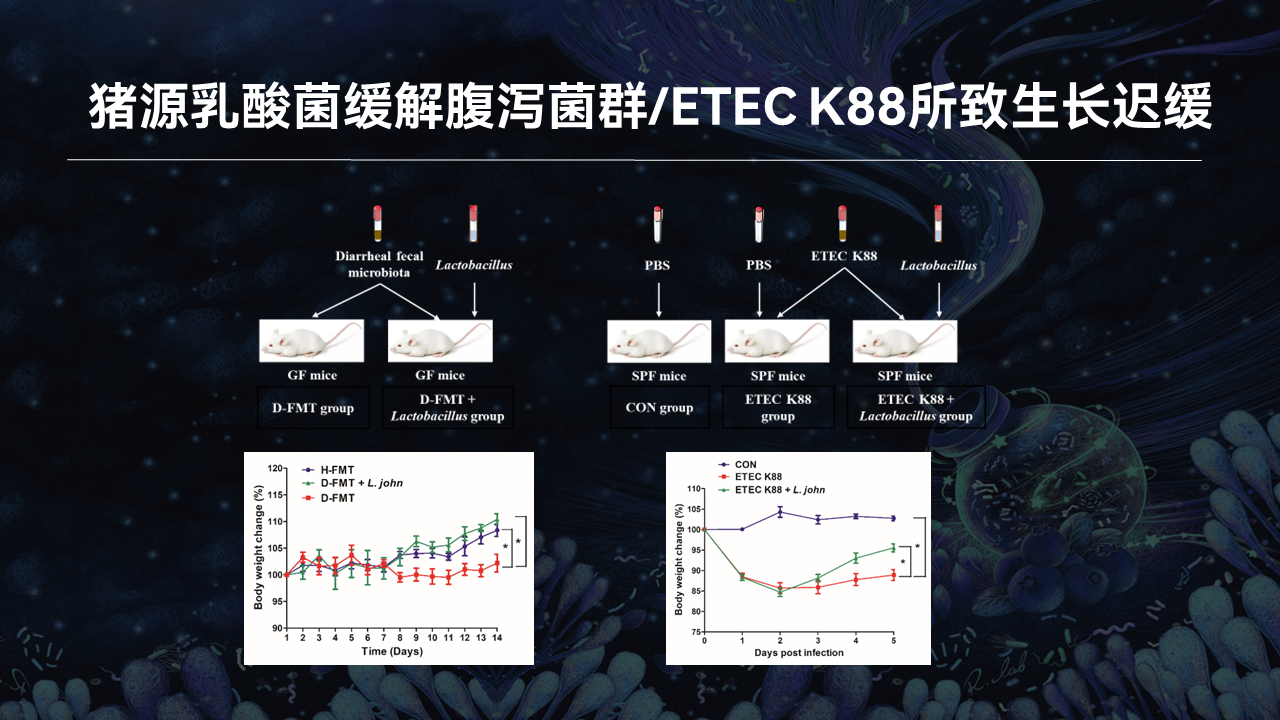
我们前面的研究结果建立了仔猪腹泻疾病与肠道微生物之间的相关性,也证明了腹泻仔猪肠道微生物与腹泻症状之间的因果关系。接下来,我们试图寻找具有抗腹泻疾病潜力的益生菌,并阐明其中的机制。
我刚才提到,一些特定的健康仔猪来源的乳酸菌可能具有潜在的抗腹泻功效,我们实验室也分离培养得到了这些菌株。为了验证这些乳酸菌是否能缓解腹泻疾病症状,我们同时进行了约氏乳杆菌、黏膜乳杆菌和罗伊氏乳杆菌的干预实验。
在这里,以约氏乳杆菌为例分享我们的结果。我们发现,约氏乳杆菌干预可以显著缓解由腹泻仔猪粪菌悬液和致病性大肠杆菌ETEC K88所致的小鼠生长迟缓。
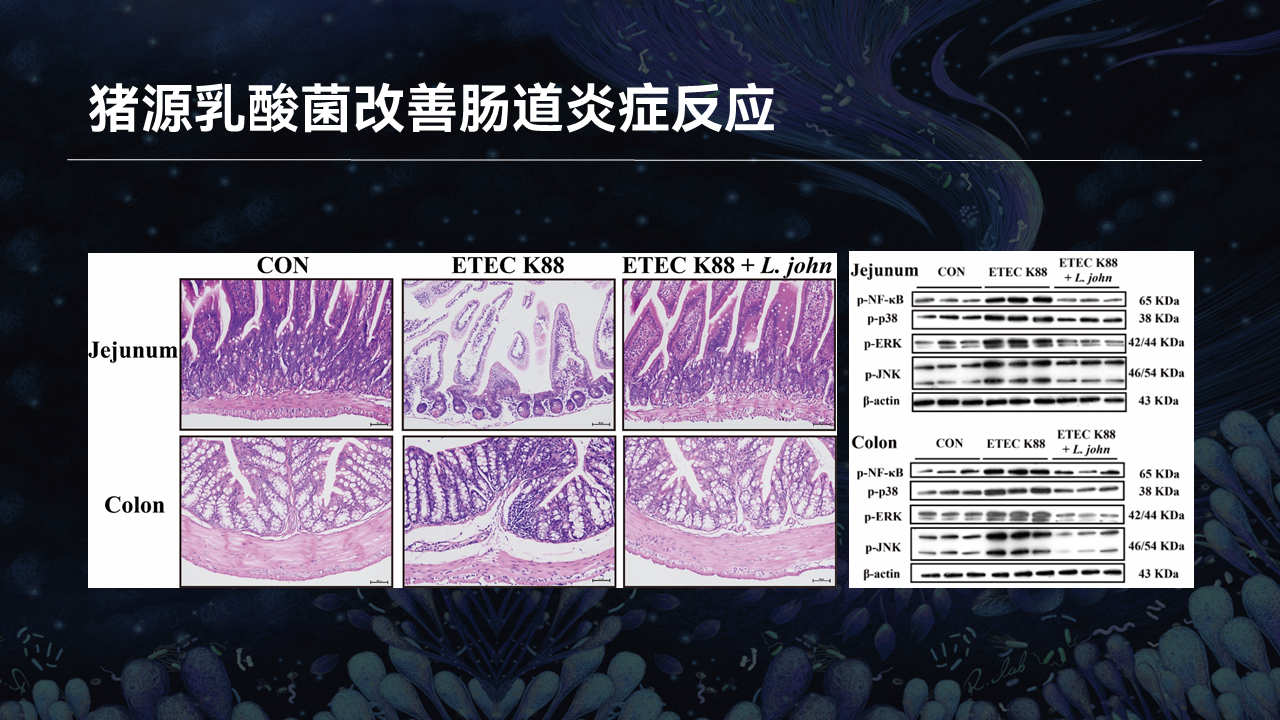
约氏乳杆菌,同样减轻了两种疾病模型下小鼠空肠绒毛、结肠病理损伤的程度。此外,促炎信号通路中关键效应蛋白的表达,在约氏乳杆菌干预后也得到了明显的下调。
这些结果提示,特定的猪源乳酸菌具有良好的缓解肠道炎症和腹泻疾病的潜力。
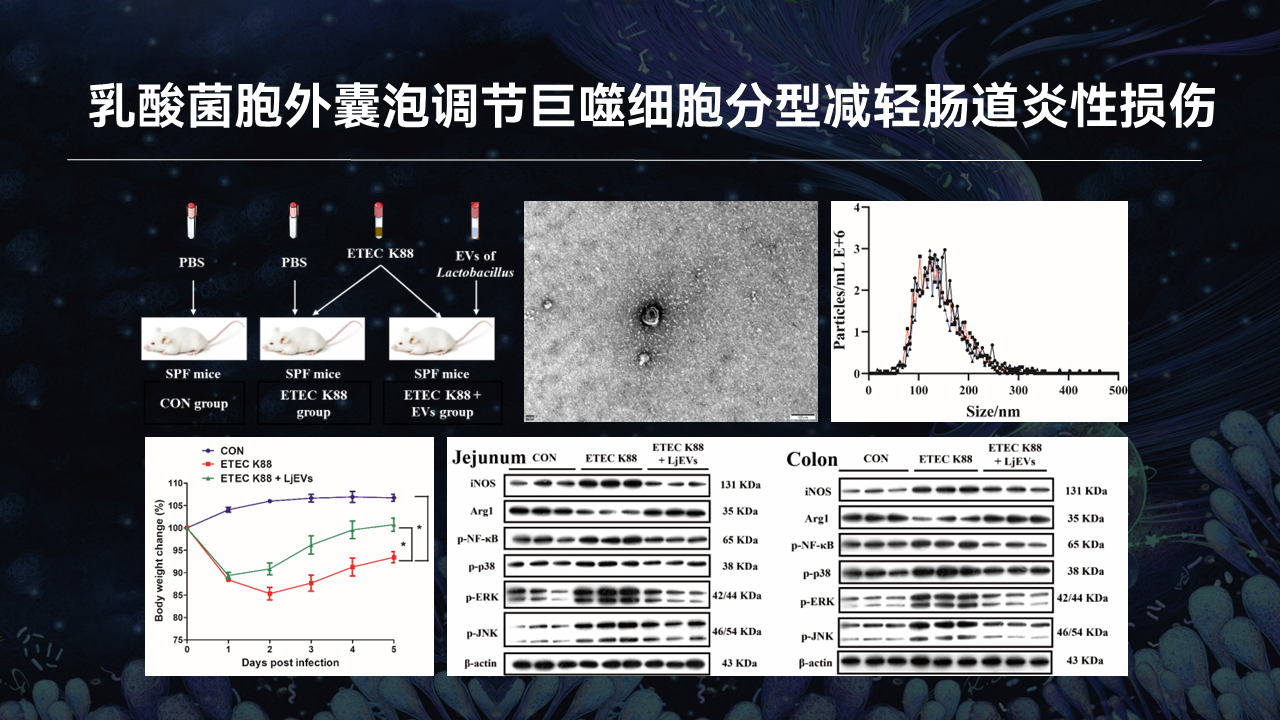
微生物对宿主生理功能的调控,除了与宿主直接相互作用外,还可以通过分泌生物活性介质来介导。其中,益生菌衍生的胞外囊泡具有广阔的研究前景。因此,我们进一步提取了乳酸菌的胞外囊泡,使用经典的方法对其进行了表征,并执行了乳酸菌胞外囊泡的干预实验。
我们发现,约氏乳杆菌的胞外囊泡发挥着与其亲本细菌类似的功效,主要表现为缓解生长迟缓和抑制肠道促炎信号通路表达。
值得注意的是,巨噬细胞分型标志物的表达在胞外囊泡干预后发生了明显的变化,提示胞外囊泡可能通过调节巨噬细胞分型减轻肠道炎性损伤。
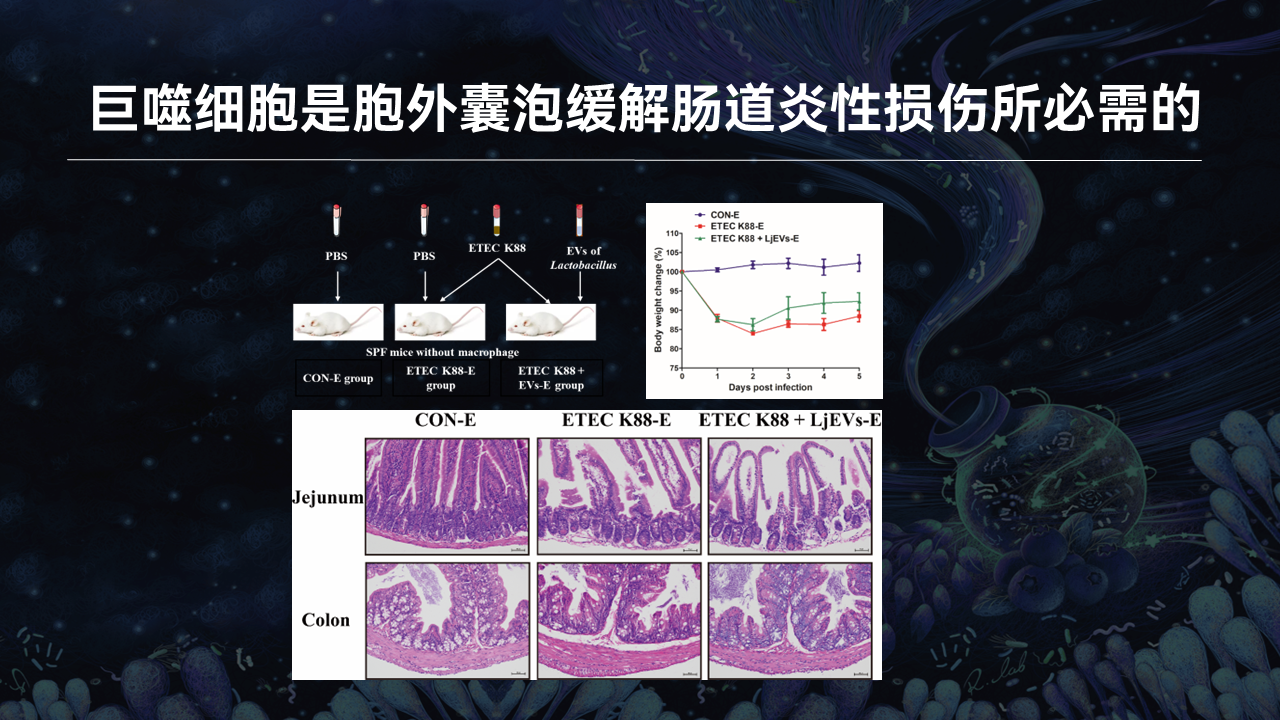
为了证明巨噬细胞在胞外囊泡缓解肠道损伤中的作用,我们使用脂质体清除小鼠体内的巨噬细胞后重新进行了胞外囊泡的干预实验。
结果表明,在缺乏巨噬细胞的小鼠中,胞外囊泡丧失了对生长迟缓和肠道炎症反应的缓解作用,证明巨噬细胞是胞外囊泡缓解肠道炎性损伤所必需的。
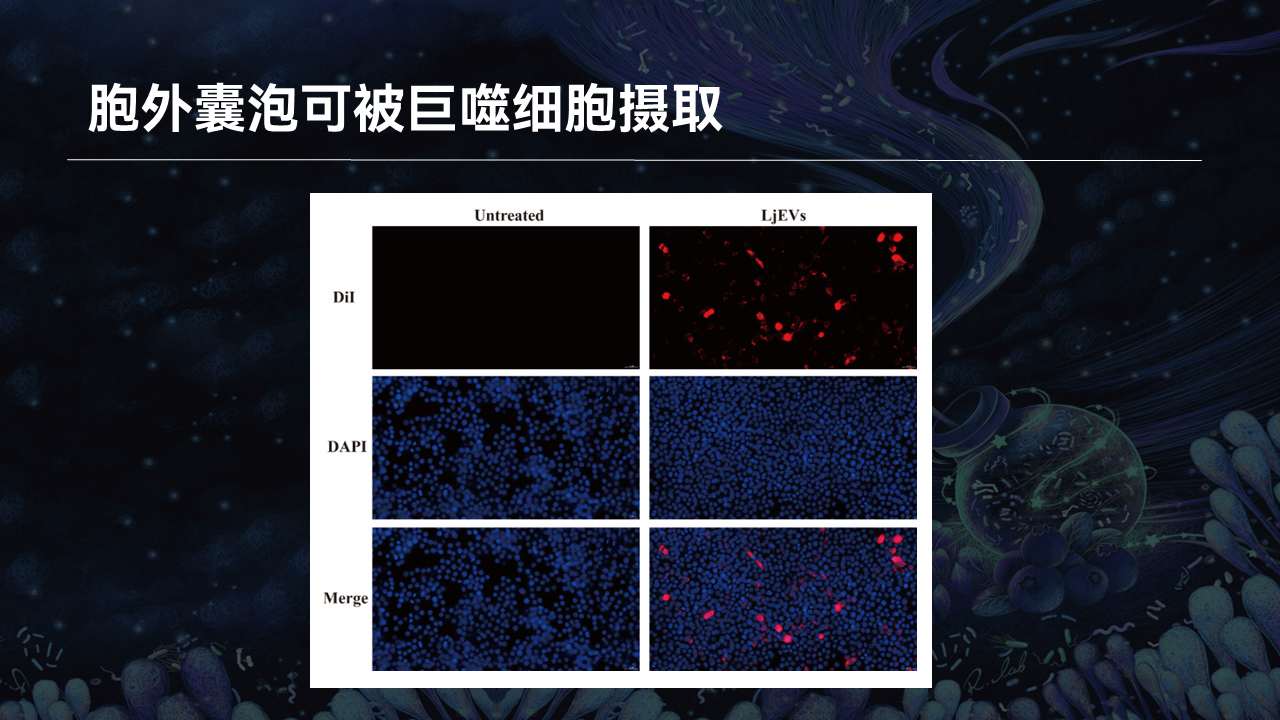
那么胞外囊泡是如何调控巨噬细胞分型的呢?
为了回答这个问题,我们首先进行了巨噬细胞的胞外囊泡摄取实验。通过这个图我们可以看到,将荧光标记的胞外囊泡与巨噬细胞共培养后观察发现,胞外囊泡可以被巨噬细胞所直接摄取。

而通过检测巨噬细胞分型标志物,我们发现胞外囊泡增强了M2型巨噬细胞极化。为了解析这一效应的分子机制,我们对巨噬细胞进行了转录组分析并结合蛋白表达进行验证。我们发现,MAPK信号通路在胞外囊泡增强M2型巨噬细胞极化过程中发挥重要作用。
进一步使用MAPK信号通路广谱抑制剂,以及p38、ERK和JNK的特异性抑制剂处理巨噬细胞后发现,只有ERK的抑制能够促进M2型巨噬细胞的极化。
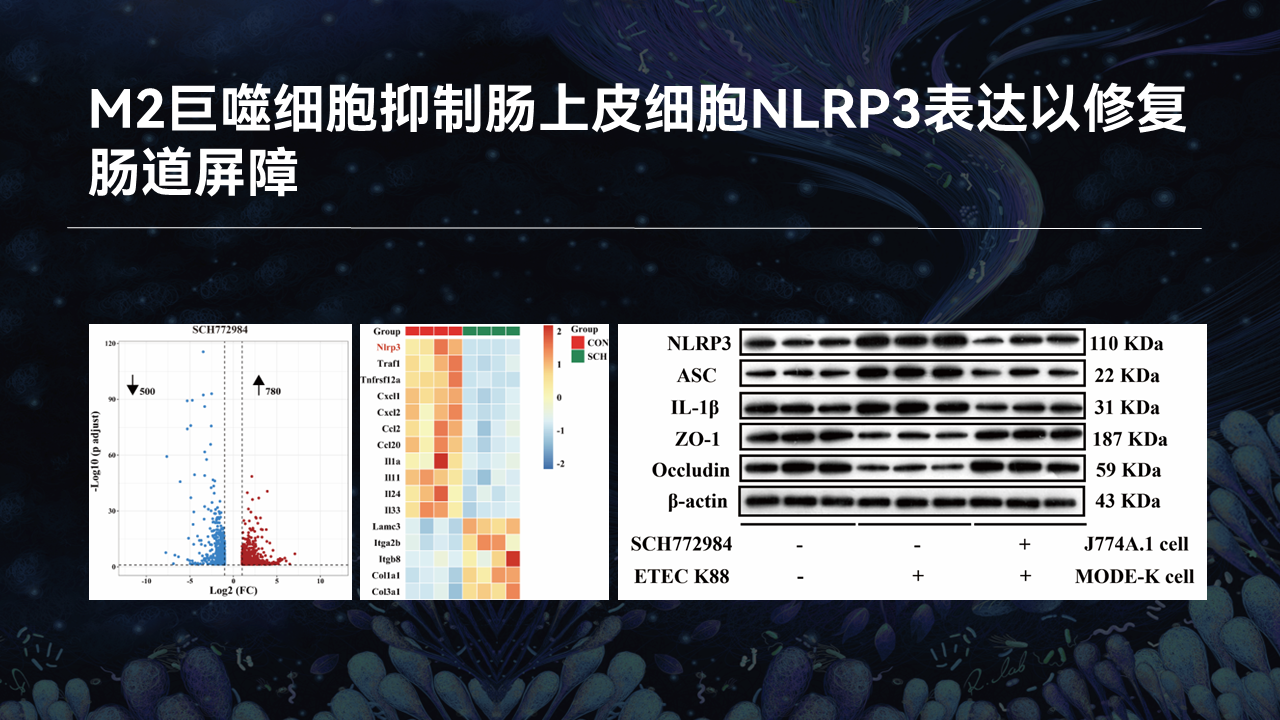
接下来,我们通过建立ERK抑制剂处理的巨噬细胞与ETEC K88处理的肠上皮细胞共培养模型,从巨噬细胞与肠上皮细胞互作的角度,解析M2型巨噬细胞如何缓解肠道炎性损伤。
转录组结果表明,共培养系统中的肠上皮细胞的基因表达谱发生了剧烈的变化,其中以NLRP3为代表的促炎基因的表达均显著降低。验证实验表明,肠上皮细胞的NLRP3、ASC和IL-1β的蛋白表达均显著降低,而紧密连接蛋白ZO-1和Occludin则显著升高。
这些结果共同表明,猪源乳酸菌分泌的胞外囊泡通过抑制ERK表达而激活M2型巨噬细胞极化,M2型巨噬细胞通过阻断NLRP3信号通路以增强肠道屏障功能。
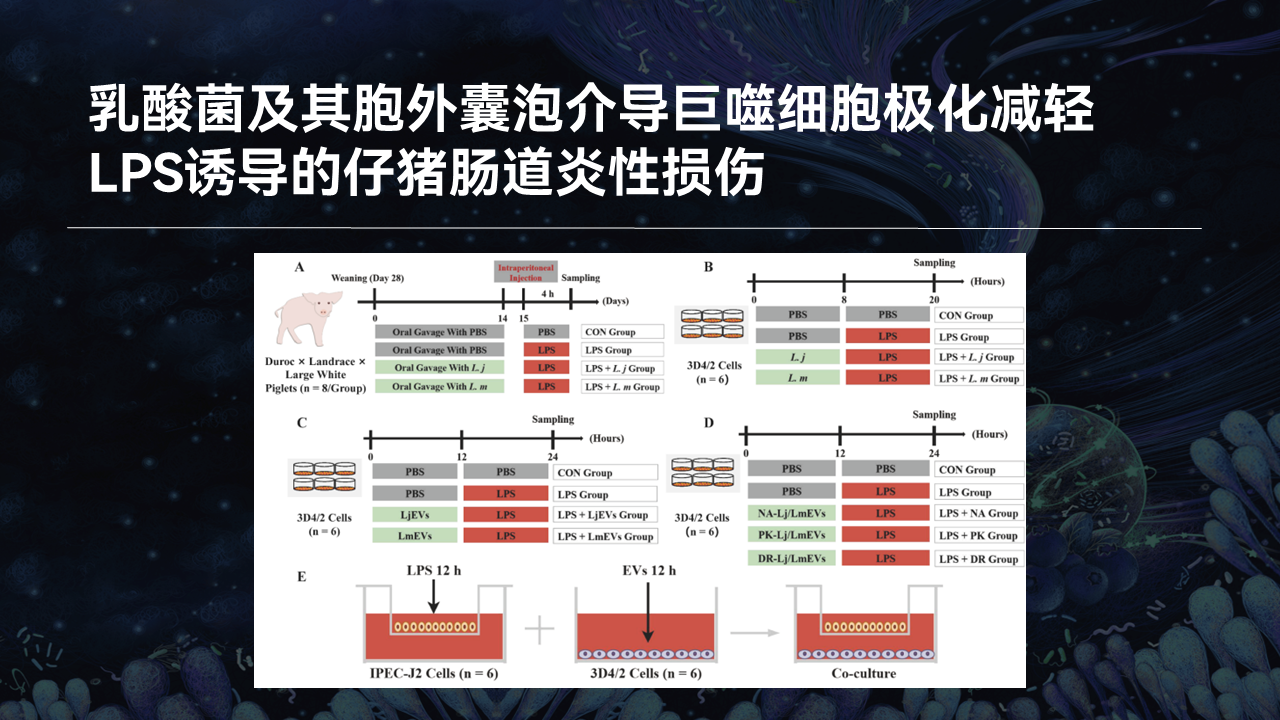
上述工作中乳酸菌及其胞外囊泡的功效和机制,我们也通过动物实验和体外细胞实验,在LPS诱导的仔猪肠道炎性损伤模型下进行了验证。
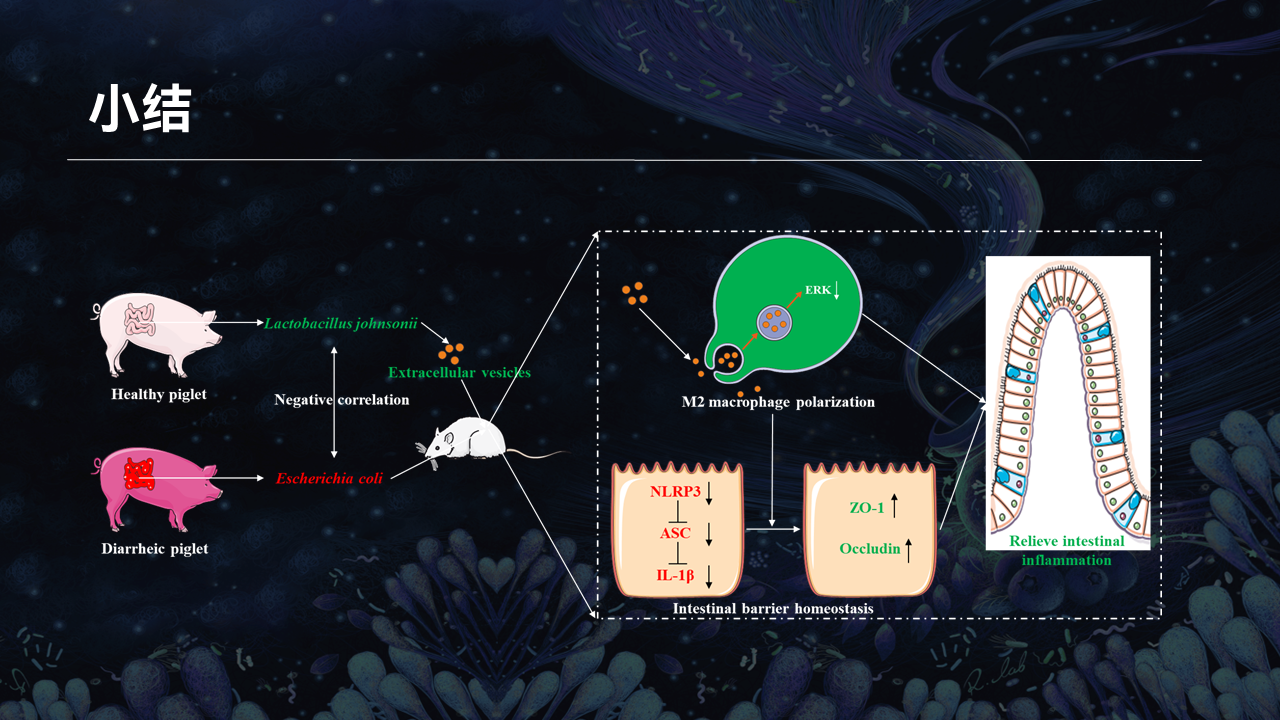
对我们的工作做一个小结,我们发现腹泻仔猪肠道微生物组失调,大肠杆菌、特定乳酸菌分别是与腹泻疾病密切相关的潜在有害微生物和有益微生物。腹泻疾病的关键生理和免疫学特征,可以通过FMT在无菌小鼠中重现。
此外,从健康仔猪分离的特定乳酸菌及其分泌的胞外囊泡,通过控制炎症反应减轻腹泻症状,其中巨噬细胞的表型转化是缓解腹泻的必要条件。
机制上,胞外囊泡通过阻断ERK的表达,来调节巨噬细胞向M2抗炎表型转化,进而阻断肠上皮细胞的NLRP3信号通路,修复肠道屏障功能。

基于我们初期的探索工作,我们持续思考,还有一些需要继续解决的问题。
一是,需要深入解析乳酸菌胞外囊泡中哪些关键组分在发挥作用,比如哪种蛋白质或哪种核酸等。
二是,需要思考乳酸菌胞外囊泡如何在养猪生产中高效应用,这其中涉及胞外囊泡的规模化生产和长期保存条件等问题。
关于这两个问题,我们正在积极探索,也欢迎各种形式的合作研究与应用推广。

我的分享到此结束。感谢基金委、科技部等项目的支持以及团队各位同学的付出。

感谢热心肠研究院,感谢大家的聆听!


