编者按:
随着微生物组疗法的蓬勃发展,当前越来越多的候选药物进入了临床后期阶段。其中,针对艰难梭菌感染的微生物组疗法走在前列,首先获得了 3 期临床试验的阳性。但是这些疗法是否能获得 FDA 的批准,顺利商业化呢?商业化后又会遇到哪些障碍呢?
今天,我们共同关注微生物组疗法。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
复发性艰难梭菌感染(rCDI)是医疗系统面临的一个巨大问题,亟需有效的解决方案。3 月初,辉瑞公司3期试验的失败使得疫苗不太可能很快到来,这意味着微生物组疗法可能首先进入市场。
Ferring pharmaceuticals 公司已经在美国提交了其开发的灌肠方案,Seres Therapeutics 公司则计划在接下来的几个月内提交与雀巢合作开发的CDI口服药物,即 SER-109的生物制品许可申请(BLA)。
但是公正地说,相比于传统生物制药,微生物组仍然被认为是边缘领域。
所有正在开发的治疗 CDI 的微生物组疗法都是基于同样的想法:在患者使用抗生素后,有毒的艰难梭菌菌株仍可在患者肠道内增殖,这有时会导致复发性感染甚至造成死亡,与此同时,艰难梭菌还具有令人难以置信的传染性。基于此,许多人认为,通过施用“好”菌,可以抑制这些不受欢迎的菌株,从而恢复患者的肠道微生物组。
研发人员表示,目前正在进行临床试验的项目比其来源——粪菌移植(FMT)更像药物。这在某种程度上是正确的,尽管纯化和制造过程的差异以及所使用的原材料的不同,使某些公司的候选药物与FMT更接近。
目前,CDI 项目进入 3 期临床阶段的有三家公司,包括 Seres、Ferring和Finch Therapeutics。这 3 家公司致力于从健康人捐赠的粪便中提取菌株,并通过筛选和纯化步骤,将菌群分离,并消除其中潜在的病原体,然后再将菌群输送给患者。
然而,上述方法的严谨性并不是总能让监管者放心。上个月,FDA 暂停了 Finch 公司的 3 期临床试验Prism4 研究,原因是担心其供体筛选方案可能不足以排除新冠病毒的传播。
而这正是 Destiny Pharma和Vedanta Bioscience 公司进入临床后期阶段的 CDI 项目可能存在优势的地方。这两家公司研发的候选药物的成分是特定微生物物种,而不是来自捐赠者的全部微生物。其中,Vedanta 的 VE303 包含 8 种细菌,Destiny 的 NCTD-M3 则只含有 1 种细菌。
如果仅从安全角度来看,这些更简单的方法可能对监管机构更具吸引力,生产成本也应该更低。但这两个项目都还没有进入第 3 阶段,监管机构特别是 FDA,将首先评估 Seres 和 Ferring 公司的微生态产品。
FDA 已经在审查 Ferring 公司的 RBX2660,但具体状态尚不清楚。Ferring 公司承认其提交了一份 BLA,但不会就申请的时间或状态提供任何最新的消息。
RBX2660 最初由一家美国生物技术公司 Rebiotix 公司研发。2018 年,Ferring 公司收购了这家公司。目前,还有一项关于 RBX2660 的大型开放标签研究仍在进行中。
Seres 公司则正在等待 SER-109 开放标签试验的结果,这一试验的目的是为提供 SER-109 申请所需的安全数据。该公司预计一项 3 期试验就能提供足够的疗效证据。SER-109 是由厚壁菌门产生的具有活性、经纯化的孢子组成的。
由于只有这两个项目的3期数据,很难知道不同的细菌成分是否会对疗效产生很大的影响。到目前为止,SER-109 似乎更具有优势,然而两者在试验设计上的重要差异使得我们难以直接比较两者的结果。
例如,SER-109 的 Ecospor 3 试验选择了高度难治的人群,患者在过去 12 个月中至少有三次艰难梭菌的复发感染,其中近一半的患者有四次。而在 RBX2660 的 Punch CD3 研究中,受试者只需要一次或两次复发。
与首次复发的情况相比,Seres 所针对的难治性情况被允许商业化机会可能更小,因为它具有孤儿药的地位,但考虑到死亡率和发病率负担,那么这种情况被认为是一个非常强的需求,这可能会改变监管机构的风险/收益计算。
然而有趣的是,SER-109 的开放标签试验确实包括了一些首次复发的个体。如果治疗复发性艰难梭菌的广泛标签获得批准,包括能够治疗早期阶段的患者,这将是 Seres 和雀巢公司的一大胜利。
当然,Ferring 公司的“2660”是通过灌肠给药的,这可能是一个主要的商业劣势,而且对该公司来说,后续的口服项目也陷入了困境。Ferring 表示,一个与第三方供应有关的“意想不到的问题”推迟了该项目的关键 Restore 3 试验的开展,并且否认了不良的安全性或有效性是造成该试验停滞的原因。
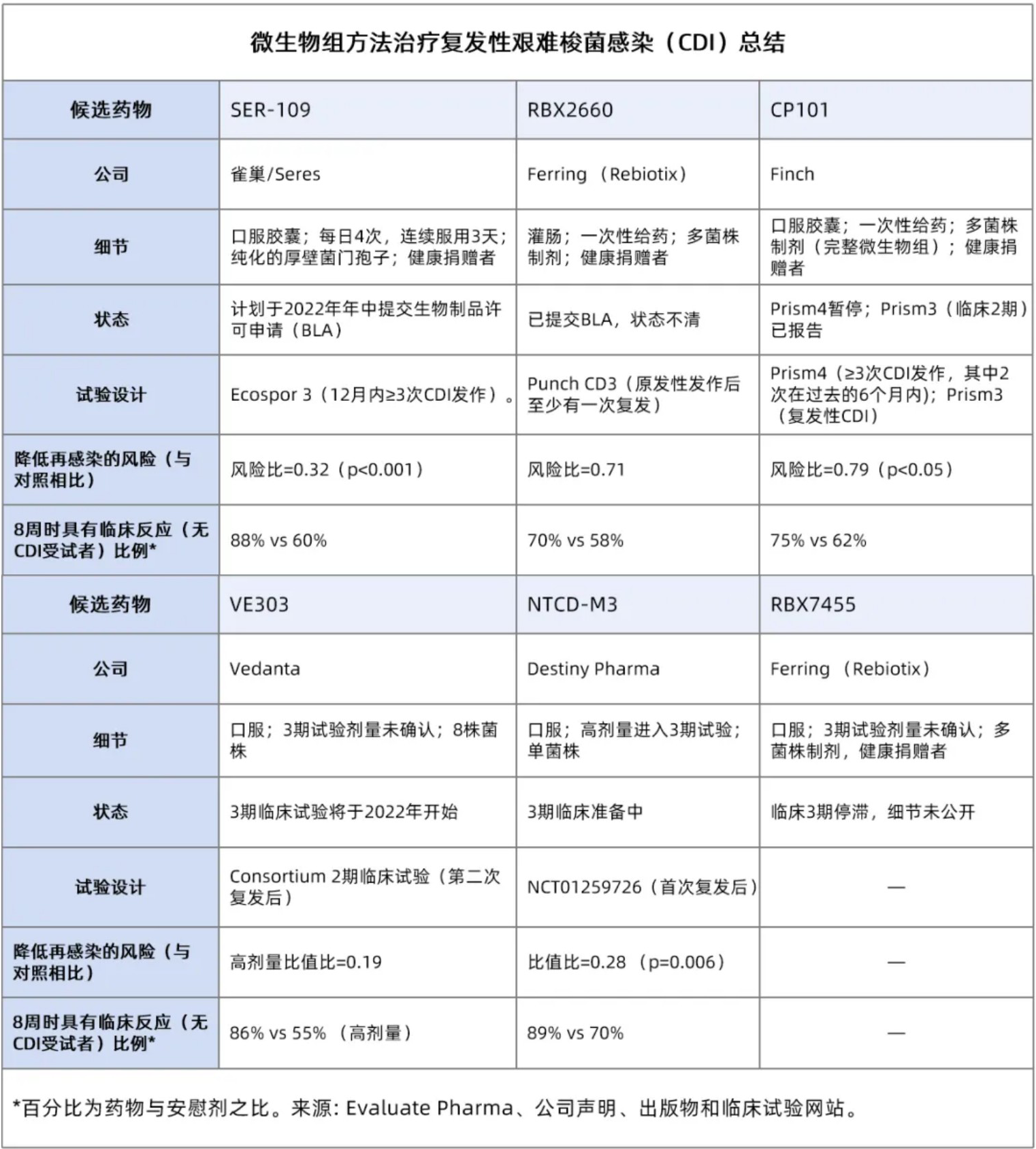
Finch 应该是下一个产生关键数据的公司,Prism4 研究结果本来预计于明年上半年发布。然而,在临床试验暂停的情况下,这一时间看起来应该会推迟。
Vedanta 公司已承诺在今年年底前将其候选药物投入到关键测试。然而,只有高剂量的药物在 2 期临床中成功,患者必须连续 14 天每天服用 10 粒胶囊,这显然是一个很大的负担。目前还没有关于第三阶段试验的细节,所以也许剂量已经得到了优化。该公司目前已获得高达 7700 万美元的资金,以将 VE303 推向市场。
最后一家公司 Destiny Pharma 表示,NTCM-M3 是最简单的,因为它只包含一株细菌。但是,该公司需要一个合作伙伴来推进这个项目。
复发性艰难梭菌感染每年导致数千人死亡,并使数百万人住院治疗,因此显然有空间推出几种产品。尽管有不可否认的需求,但这感觉像是一个将面临与新型抗生素相同问题的市场,例如,尽管是救命稻草,但它的定价并未得到支持,以达到像癌症药那样的昂贵程度。
也许这就是为什么 Seres 公司选择了一个超级难缠的情况,在这种情况下,要求更高的价格的诉求可能更容易获得批准。因此,虽然这些方法背后的科学仍然需要证明,但缺乏定价权实际上可能是使微生物组成为主流的一个更大的障碍。
原文链接:
https://www.evaluate.com/vantage/articles/analysis/spotlight/year-regulators-meet-microbiome
作者|Amy Brown
编译|Alex Zhang
审校|617
编辑|豫小鱼


