编者按:
目前,有超过 40 个关于微生物疗法的临床试验正在开展之中,我们离第一个获得 FDA 批准的微生物疗法越来越近。尽管我们已经清楚意识到微生物疗法具有巨大的前景,但是研发过程依然面临着许多的挑战,包括给药方面。
比如,近期,公布了临床 III 期阳性结果的 Seres Therapeutics 公司就提出可能是因为剂量问题导致了其 II 期临床试验的失败。
那么,微生物疗法究竟面对着哪些挑战?是否有可能通过改变药物递送解决?
今天,我们特别编译了 Journal of Experimental Medicine 杂志上题为“Microbial therapeutics:New opportunities for drug delivery”的文章。希望本文能够为相关的产业人士和诸位读者带来一些帮助和启发。
微生物治疗疾病
在现代医学史中的大部分时间里,微生物理论将微生物视作我们的敌人。但现在我们已经非常清楚,微生物也可以用于治疗。
事实上,越来越多的公司开始开设微生物疗法相关的研发管线(表 1)。然而,要成功地将这些微生物疗法应用于广大患者群体,我们仍面临着一个重大的挑战——药物递送。
从少数已存在的活细菌预防疫苗以及最近用以治疗复发性艰难梭菌感染的粪菌移植(FMT)方法中,显然易见地可以看到微生物疗法的潜力(Dermer and Glenting,2006;Kelly,2013)。
虽然粪菌移植在对抗艰难梭菌方面已经成为微生物疗法最引人注目的早期成功,但是这些方法仍然是实验性的,有很多标准化和规范这一方法的工作正在进行中(表1:FDA,2016b)。不过这一早期成功表明,微生物用于治疗疾病是可行的。
实际上,早在粪菌移植出现之前,“微生物组健康与它潜在的调节作用”的观念就已经渗透到了普通大众之中,促进了作为食品补充剂销售的益生菌的商业发展。但是,这些食品补充剂应用于不同情况时,呈现出了复杂的结果(Gareau et al,2010)。相比之下,微生物药物研发新领域旨在开发具有特定医疗功能和靶向性的微生物。
合成生物学工具的出现,让我们能够更精确地设计微生物的功能,并通过微生物组研究了解微生物影响人类健康的具体机制,带来了新希望(Mimee et al, 2016)。
借助这些工具,各个公司现在瞄准了几种治疗模式,如清除有毒分子(如 Synlogic 公司);原位生产具有治疗作用的分子(例如 ActoBio 公司); 基因有效载荷的细胞内传递(如 Adhera 公司);取代感染性病原体(例如 Seres 公司); 免疫系统调节(如 Evelo 公司)以及重新建立标准化的微生物组(如 NuBiyota 公司)。
过去十年间,这一领域不断发展,许多公司都得到风险投资并进入到了药物审批流程中。
2012 年,美国 FDA 提出了对于“活体生物疗法(LBP)”在早期临床试验中的使用指南(FDA,2016a)。现在,随着制药公司完成了 I 期临床试验,FDA 将继续探讨生产和评估这一新品类的活性药物成分(active pharmaceutical ingredient,API)的合适方法(FDA,2018)。
为了进行更大范围的 III 期临床试验并最终广泛服务于患者,这一领域已经开始解决筛选、标准化并组合配制这些微生物 API 的问题。
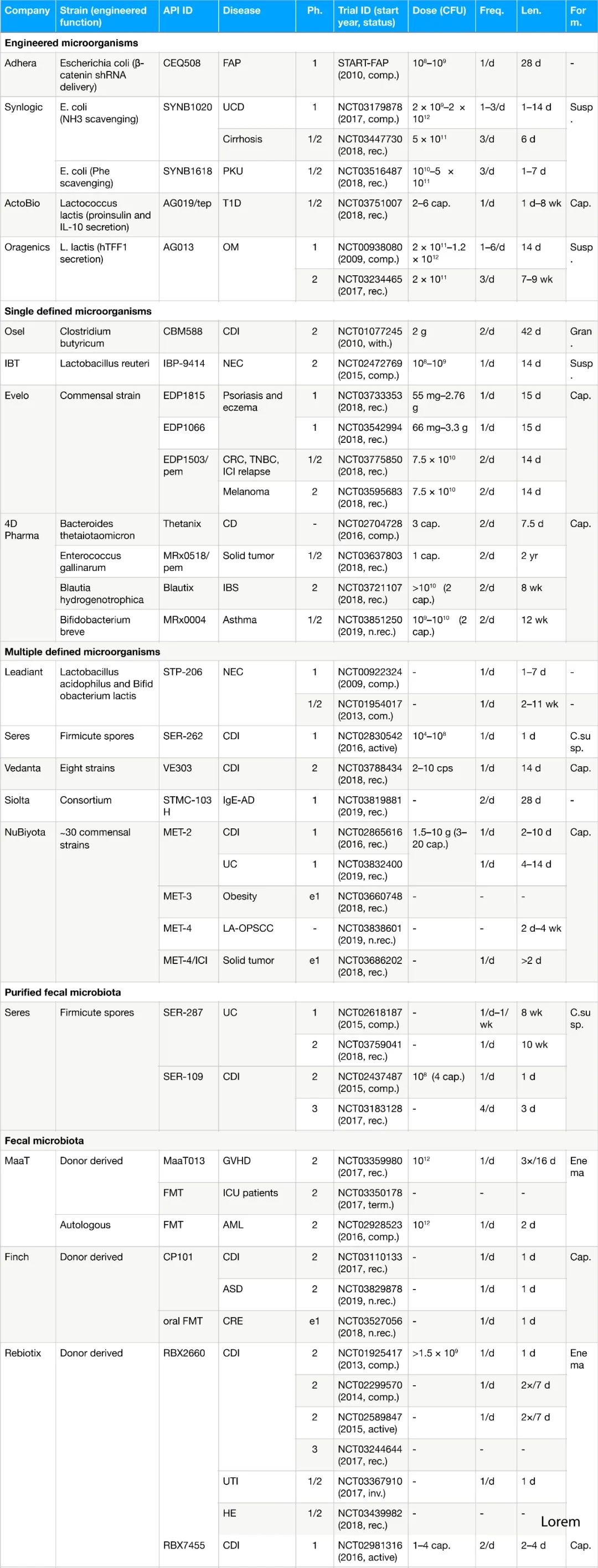
表1.Ph.临床试验阶段;Freq.给药频率;Len.给药时间;Form.给药形式;hTFF1, human trefoil factor1;tep,teplizumab;pem,pembrolizumab;FAP,家族性腺瘤性息肉病;UCD,尿素循环异常;PKU,苯丙酮尿症;T1D,1型糖尿病;OM,口腔粘膜炎;CDI,艰难梭菌感染;NEC,坏死性小肠结肠炎;CRC,大肠癌;TNBC,三阴性乳腺癌;ICI,免疫检查点抑制剂;CD,克罗恩病;IBS,肠易激综合症;IgE-AD,特应性免疫球蛋白E介导的过敏性疾病;UC,溃疡性结肠炎;LA-OPSCC,头/颈鳞状细胞癌;GVHD,移植物抗宿主病;ICU,重症监护病房;AML,急性髓细胞性白血病;ASD,自闭症谱系障碍;CRE,耐碳青霉烯的肠杆菌科;UTI,尿路感染;HE,肝性脑病;e,早期;comp.,完成;rec.,招募;with.,撤回;n.rec.,尚未招募;ter.,终止;inv.,邀请参加;susp.,悬液;cap.,胶囊;c.susp.,封装的悬液。
具有挑战的独特医疗机遇
活性微生物 API 完全不同于生物制剂和小分子 API。这种差异正是其潜力所在,但也给生产、给药和评价方面带来了重大挑战。与纯化的单一分子不同,活性微生物 API 包括活细胞的所有分子机制,如细胞的自我更新、基因编码功能、多种混合分子相互作用和适应性反应。
自我更新
自我更新意味着具有发展成为治疗方式的潜力,即仅需要使用一次即可在很长一段时间内产生显著的治疗效果。虽然这种能力可能是为慢性疾病开发出像疫苗一样的疗法的关键,但是自我更新使得微生物 API 的药代动力学(pharmacokinetics,PK)更为复杂了。
微生物细胞分化的速率很大程度上与患者相关的特异性因素相关,比如食物的摄入、原生微生物组和疾病状况。因此,微生物 API 的自我更新可能会带来显著的可变性,这为基于小规模的I期临床试验制定有效的给药方案带来了挑战。
而且,自我更新会破坏生物防护(biocontainment)并且可能会随时间的推移导致微生物 API 出现基因漂移。
像 Synlogic 这样的公司仅将他们的微生物 API 作为一种生产过程中提供必需营养素的助养剂(Kurtz et al.,2019)。这能防止它在患者机体中复制,简化药代动力学模型并降低遗传漂变的风险。其他人则设计了基因自杀开关,让逃逸的微生物细胞进行自我毁灭(Lee et al, 2018)。
基因编码的功能
微生物 API 的遗传基础使得它们成为灵活的医药载体。药物发现和先导物优化的过程可以利用多种遗传工具来构建并筛选合适的工程微生物。
像 Ginkgo Bioworks 这样的公司正在将这种 DNA 驱动的构建-设计-测试的周期商业化,使我们尽早了解未来可能开发的微生物 API 的规模。
除此之外,像 Finch 这样的公司正在利用下一代测序技术从患者自身的微生物组中鉴定并分离出潜在的可用于治疗的微生物。
但是,由于最终的医疗功能的是由 DNA 编码,容易受到基因突变和基因水平转移的影响,因此,限制基因漂移的方法对于保证微生物 API 的遗传稳定性至关重要(Lee et al.,2018)。
此外,在药物开发过程中,可以利用全基因组测序来了解每一种微生物 API 的遗传失效模式。
多种分子相互作用
微生物 API 同时会呈现出多种分子相互作用(如蛋白质、肽类、碳水化合物、脂肪、代谢物和核酸),每一种都可能具有潜在的医疗作用。比如,活的微生物疫苗和其他免疫调节微生物 API 依赖于这些混合的分子相互作用来作为其佐剂发挥作用。
尽管前景广阔,但是即便是在没有刻意设计某种特定的医疗效果的情况下,也会存在这种混合分子相互作用。这代表着可能存在多种非靶向的相互作用。尽管如此,由于大部分微生物 API 仅限于消化道内腔发挥作用,所以大部分的相互作用都未涉及到更广的人体生物学范畴。
然而,细胞间的相互作用的化学计量可能存在固有的异质性,这会为使用这些复杂的 API 带来挑战,因此,补充多种类型的生化实验以进一步探究这些基因的特征是必需的。
适应性反应
微生物 API 对环境的适应和响应能力为形成闭环疗法提供了巨大潜力。
基因编码的生物感受器(genetically encoded biosensor)能够检测临床相关的生物标志物,这种感受器可以被用于监控治疗功能(Mimee et al.,2016)。然而,尽管可以在实验室环境中利用这种先进的自适应功能,但是它们能否在肠道中坚定地发挥作用,仍然有待观察。
可能由于这种设计上的挑战,通过审批流程的第一代微生物 API 要么未经修改,要么只进行了单一遗传功能设计改造(表 1)。但是,随着这一领域越来越多地了解到肠道环境对这些 API 的影响,我们期待第二代微生物药物能够体现出更为高级的适应性功能。
即便困难,但是开发这样的适应性系统可能可以反过来被用于克服上文中概述的许多挑战,就像适应性的微生物 API 可能被设计用于在不同状况的患者群体中达到一致的医疗效果。或者说,直接从原有微生物组中分离的未经修改的微生物 API 可能已经依赖于内源性适应性系统。理解这些机制将有助于更加先进的微生物 API 的设计开发。

图.微生物 API 包括具有明确特征、经过基因编辑的菌株到未明确特征、来源于粪便的微生物。这些 API 正在临床试验中进行疗效测试,使用的剂型在易用性和稳定性上各不相同,而且剂量使用也有很大差异。改进微生物 API 的给药方式对于开发有效的微生物疗法至关重要。
给药方式的思考
微生物 API 给药和生产面临着独特的挑战和机遇。
由于这些 API 是活的细胞,所以标准的药理学过程(吸收、分布、代谢和排出)就存在显著差异。针对仅局限于在胃肠道的微生物 API,我们可能只需要考虑它在胃肠道内的分布、定殖、复制和脱落(giDARS)。这将改变我们对于如何通过配方和剂型设计来调节药代动力学的思考。
此外,制药生产必须适应这种敏感的微米级 API。
用于保护益生菌的微生物菌种库方法已经为当前的临床试验提供了起点。这意味着要给患者服用新鲜解冻的液体微生物悬浮液或装有冻干微生物的冷冻明胶胶囊。这些方法为监测患者体内的微生物 API 提供了直接的测量途径。
但是,它们是无法扩展的,难以针对特定疾病状况调整 giDARS。这一领域面临的挑战是调整目前的给药方法,使得微生物 API 的给药具有可伸缩的剂量、长期稳定性和精确靶向性。
给药剂量
现有的临床试验为微生物 API 需要的剂量和给药方案提供了一些线索和启示。
对于可能需要较低剂量的免疫调节,患者可以每次摄入 109~1010CFU 的剂量,一天两次,持续 14~28 天(如 Evelo 和 Adhera)。这与活的口服微生物疫苗的剂量(4×109-1010)一致,此类疫苗一周之内仅需摄入 1~4 次(FDA,2013,2016C)。
对于可能需要更高的剂量摄入的以清除毒性分子或递送蛋白质为目的的应用,患者需要每次摄入1011-1012CFU,每天 2~3 次,持续 14 天到 9 周(e.g., Synlogic and Oragenics; Kurtz et al., 2019)。与此一致的是,Seres 公司最近指出,如 108 这样的低剂量可能是其 II 期临床试验有效性不佳的原因(Henn et al., 2018)。
那么,这就引发了一个问题:这些剂量和给药方案可以通过更好的给药方式来增强微生物 API 的稳定性和靶向性吗?
稳定性
如现今的生物制剂一样,微生物 API 同样会受到热处理和化学物质的破坏。除此之外,微生物 API 还含有脆弱的脂肪膜。这种脆弱性在生产、贮存和摄入过程中也存在着稳定性的问题。
现有的生产过程将 API 暴露于苛刻的溶剂、温度和压力环境中。这些过程是否适用于微生物 API?虽然用于食品加工的活性酵母的大规模生产证明,这是可行的,但是,我们知道,酵母具有内在的抗逆性(Attfield,1997)。
此外,虽然目前的生物制造工艺已经能够生产大量用于制造蛋白质的微生物,然而,细胞的存活率受到很少关注(Huang et al.,2012)。
鉴于贮存期的稳定性,现有的微生物 API 需要冷链贮存来维持效能。在一些情况下,这甚至意味着在冷冻温度下贮存(Kurtz et al.,2019)。那么,患者能否遵循这些严苛的条件呢?是否需要他们去专门的给药机构?我们能从室温下稳定的食品级酵母小包装中学到什么吗?
一旦摄入后,微生物必须与胃中的低 pH 值和十二指肠中较高含量的胆汁盐相抗衡。目前的活的微生物疫苗使用肠溶凝胶胶囊或缓冲液来解决其中一些问题(FDA,2013,2016C)。那么,是否可以采用其他的配置方法来保护微生物 API 免受胆盐的破坏?
靶向性
现在的微生物配方所提供的靶向作用超出了微生物生物学所确定的固有范围。为了增强微生物疗法的有效性,将微生物 API 靶向送到疾病位点将会是至关重要的。这种靶向可能需要定位到特定的解剖学部位(如空肠、髂骨或结肠)或亚腔室(如腔体、粘液层或上皮)。此外,靶向也可能涉及到给药到特定的生态位(Lemon et al.,2012)。
靶向给药或可通过使用具有肠道、结肠靶向,粘膜黏附或粘液穿透性的材料来实现。生态靶向性,可以通过联合使用选择性抗生素“释放”目标生态位实现。或者,可以利用微生物 API 的基因编码特征修改其固有的解剖学和生态分布(Mimee et al.,2016)。
结论
很显然,我们距离首个 FDA 批准的微生物药物仅有几年之遥。少数公司正在通过进行复杂但必要的药物审批过程来实现这一目标。
在此过程中,这些工作也显露出关于像微生物这样的 API 的生产和给药相关的重要问题。随着这一领域的发展,必须要有新的方式方法来解决这些挑战。新的配方和剂量将会弥补微生物 API 的基因设计,以此来加强微生物疗法的有效性。
参考文献:
(滑动下方文字查看)
1.Attfield, P.V. 1997. Nat. Biotechnol. 15:1351–1357. https://doi.org/10.1038/nbt1297-1351
2.Detmer, A., and J. Glenting. 2006. Microb. Cell Fact. 5:23. https://doi.org/10.1186/1475-2859-5-23
3.Food and Drug Administration. 2013. Vivotif Typhoid Vaccine
4.Live Oral Ty21a. Version: September 2013. Available at: https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm094070.htm
5.Food and Drug Administration. 2016a. Fed. Regist. https://www.federalregister.gov/d/2016-15664.
6.Food and Drug Administration. 2016b. Fed. Regist. https://www.federalregister.gov/d/2016-04372
7.Food and Drug Administration. 2016c. Vaxchora Cholera
8.Vaccine Live Oral. Version: June 2016. Available at: https://www.fda.gov/biologicsbloodvaccines/vaccines/approvedproducts/ucm505866.htm
9.Food and Drug Administration. 2018. Fed. Regist. https://www.federalregister.gov/d/2018-17732.
10.Gareau, M.G., et al 2010. Nat. Rev. Gastroenterol. Hepatol. 7: 503–514.https://doi.org/10.1038/nrgastro.2010.117
11.Henn, M., et al 2018. Open Forum Infect. Dis. 5(suppl_1): S226–S227. https://doi.org/10.1093/ofid/ofy210.628
12.Huang, C.-J., et al 2012. J. Ind. Microbiol. Biotechnol. 39: 383–399. https://doi.org/10.1007/s10295-011-1082-9
13.Kelly, C.P. 2013. N. Engl. J. Med. 368:474–475. https://doi.org/10.1056/NEJMe1214816
14.Kurtz, C.B., et al 2019. Sci. Transl. Med. 11:eaau7975. https://doi.org/10.1126/scitranslmed.aau7975
15.Lee, J.W., et al 2018. Nat. Chem. Biol. 14:530–537. https://doi.org/10.1038/s41589-018-0056-x
16.Lemon, K.P., et al 2012. Sci. Transl. Med. 4:137rv5. https://doi.org/10.1126/scitranslmed.3004183
17.Mimee, M., et al 2016. Adv. Drug Deliv. Rev. 105(Pt A):44–54. https://doi.org/10.1016/j.addr.2016.04.032
原文来源:Jimenez M , Langer R , Traverso G . Microbial therapeutics: New opportunities for drug delivery[J]. Journal of Experimental Medicine, 2019.
作者|Miguel Jimenez, Robert Langer,Giovanni Traverso
编译|C。
审校|617


