编者按:
越来越多的研究表明肠道菌群在宿主体内有着不可或缺的作用,过去的研究已经发现肠道菌群与 2 型糖尿病、肥胖、炎症性肠病、自闭症等疾病相关。而今天我们将关注另一种慢性疼痛疾病——纤维肌痛综合征。
纤维肌痛综合征属于风湿病的一种,其最突出的症状是全身产生弥漫性疼痛,同时会合并一些其它临床表现,常见的包括睡眠障碍、躯体僵硬感、疲劳、认知功能障碍等。目前关于该疾病的病因尚不明确,但患者可能具有躯体或精神创伤史。
今天,我们将在这篇文章中介绍肠道菌群与纤维肌痛综合征之间的潜在关系,希望本文能够为相关的产业人士和诸位读者带来一些帮助和启发。

“威力”巨大的纤维肌痛综合征
纤维肌痛综合征属于一种慢性疼痛疾病,是继骨关节炎之后第二常见的风湿疾病。美国著名歌手 Lady Gaga 就备受其折磨,并因此取消其在 2017 年全年的所有行程。此外,Lady Gaga 还在社交软件上公开发布自己患有纤维肌痛综合征的消息,并希望通过这一举动引起公众对此疾病的关注。
据研究估计,纤维肌痛综合征的发病率在 2~4%之间1。2008 年,据美国的国家关节炎数据工作组(National Arthritis Data Workgroup)统计,美国有 5 百万人口受这种疾病的困扰。
患有纤维肌痛综合征的人群集中在 30 岁到 55 岁的成人之中,并且疾病状况会随着年龄的增加而加重2,尽管纤维肌痛综合征在成年人中更为常见,但是在儿童中也有发病的情况。此外,纤维肌痛综合征在女性中的发病率大于男性中的发病率3。
从上述数据我们不难发现,纤维肌痛综合征的“威力”之大,那么这到底是一种什么疾病呢?

纤维肌痛的病因与诊断
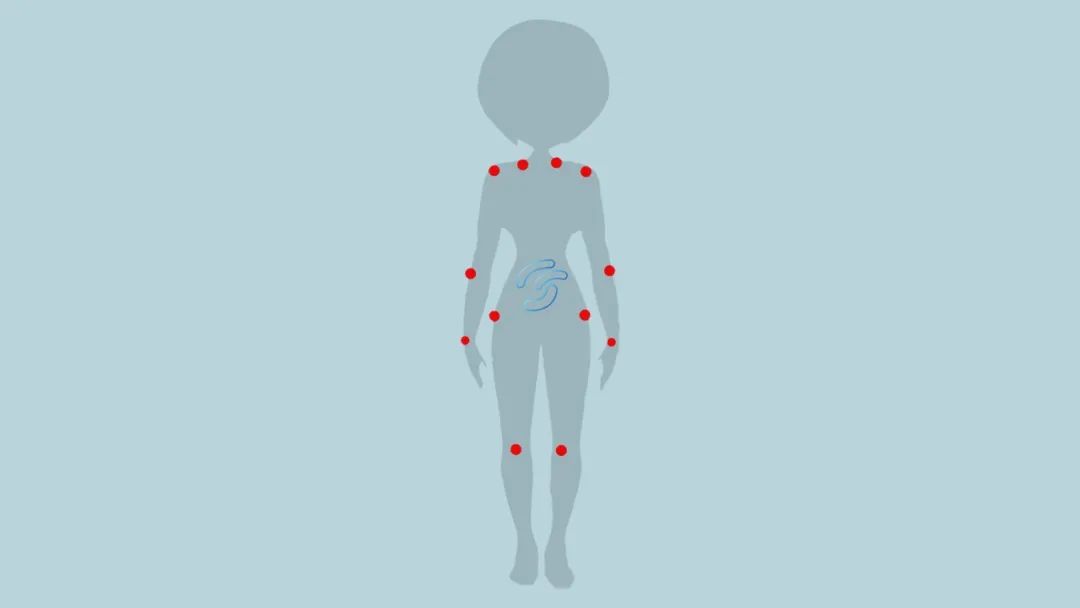
纤维肌痛综合征是一种表现症状复杂的综合征,其突出症状是全身弥漫性疼痛:痛觉过敏(对可能引起疼痛的刺激反应增强)或痛觉超敏(对通常不应引起疼痛的刺激而引起痛觉)。同时还合并一些其它临床表现,常见的包括过度疲劳、睡眠障碍、情绪变化、认知功能障碍等4。
纤维肌痛综合征的症状在 19 世纪就开始出现,并在 1970 年左右,为了更好地理解这类疾病,将这类疼痛疾病重新命名为纤维肌痛综合征(Fibromyalgia)5。Fibromyalgia 这个单词由代表纤维组织 fibrous tissue 的词根(fibro);代表肌肉(muscles)的词根(myo);代表疼痛(pain)的词根(algia)组成6。
美国风湿病学会(American College of Rheumatology, ACR)在 1990 年制定了一系列纤维肌痛综合征的诊断标准,该标准主要关注痛觉,包括在腰部周围或者身体范围内出现 3 个月或更长时间的较大范围疼痛,并确定了 18 个特定的痛点7。
2010 年,美国风湿病学会对纤维肌痛综合征的诊断标准进行了更新,增加了包括疲劳等其它症状的评估8。但是,尽管如此,纤维肌痛仍是一种较难诊断的疾病。
关于引发纤维肌痛综合征的潜在原因,目前发现有多个方面9:
首先是遗传因素,患有纤维肌痛综合征的患者的家庭成员中可能也会有慢性疼痛病史。
其次有环境因素,可能引发纤维肌痛综合征的环境因素包括涉及急性疼痛的压力源、感染、心理压力等。
患有其它慢性疼痛疾病(如骨关节炎、类风湿关节炎和狼疮)的情况下也可能引发纤维肌痛综合征。据估计,大约 10%到 30%的风湿性疾病患者也会出现纤维肌痛的症状。
此外,纤维肌痛综合征患者更有可能患精神疾病,包括抑郁、焦虑、强迫症和创伤后应激障碍等。
另外,睡眠质量差、肥胖、缺乏运动、对工作或生活满意度较差等等这些因素也被认为是纤维肌痛综合征的潜在引发因素9。
因此,心理、行为和社会问题等因素的叠加导致了纤维肌痛综合征的发病机制复杂化,也是直至今天该疾病的病因仍不明确的原因所在。
肠道菌群与纤维肌痛是否有联系
近年来随着肠道菌群研究的兴起,人们发现了肠道微生物与许多疾病之间的关系,同时还发现了肠道菌群与中枢神经系统(central nervous system)之间的联系,也就是所谓的肠-脑轴(Gut-Brain Axis)。
肠道微生物和中枢神经系统之间的联系是通过迷走神经产生的。肠-脑-微生物之间是一个相互产生复杂联系的闭环,当这个闭环中的任何一个环节出现问题的时候,都可能会对整个系统产生影响12。
而关于纤维肌痛综合征的研究已经表明,该疾病与精神疾病之间存在着紧密的关联。
不仅如此,更有报道发现,纤维肌痛患者患肠易激综合征(IBS)的可能性是其他患者的 1.5 倍,其症状包括慢性腹痛、便秘、腹泻和恶心等14。近年来的其它风湿病和肠道菌群的研究也已经发现微生物与风湿病之间的关联。
鉴于上述种种研究证据,风湿病学家、医学博士 R.Swamy Venuturupalli 笃定:“肠道健康和纤维肌痛之间一定有明确的联系。”
除了 Venuturupalli,其他许多科学家也认为肠道微生物与纤维肌痛综合征之间可能存在着的联系。

会是因果关系吗?
2017 年,美国西北大学 Potchefstroom 分校的 Carolus J. Reinecke 研究团队在一项发表于 BMC Neurology 的研究中采用代谢组学核磁共振的方法,分析了 18 位纤维肌痛综合征患者和 41 位健康人尿液样品中的代谢物差异15。
研究发现,在纤维肌痛综合征患者中,跟肠道菌相关的代谢物水平有三种是显著增高的:马尿酸、2-羟基异丁酸和乳酸。2-羟基异丁酸是纤维肌痛组和对照组之间差异较大的一种代谢物,同时此代谢物也是肠道微生物中的一种代谢产物。
肠道中的这些代谢产物的差异进一步证明了肠道微生物组与宿主健康之间的联系,同时也将纤维肌痛综合征与肠道微生物组联系了起来。
2019 年,西班牙的 Marc Clos-Garcia 及其研究团队为了探索纤维肌痛的发病机制和挖掘可用于诊断的生物标志物,他们结合了微生物组技术和代谢组技术,将 105 位纤维肌痛综合征患者与 54 位健康人群进行比较,分析研究了他们的粪便样品和血液样品16。
这项研究发现,纤维肌痛综合征患者中的细菌 alpha 多样性降低。患者体内双歧杆菌属(Bifidobacterium)和真杆菌属(Eubacterium,一种参与宿主神经递质代谢的细菌)的数量显著减少。
而血清代谢组分析发现,谷氨酸和丝氨酸的水平发生了变化,这暗示神经递质的代谢发生变化。同时,血清代谢组学和肠道微生物组学这两方面的数据具有一定的相关性,也进一步证明了微生物组对代谢具有影响。
同年,来自麦吉尔大学的研究团队 Amir Minerbi 等人对 77 名女性纤维肌痛患者和 79 名对照的微生物样品进行了分析研究,研究发现了纤维肌痛患者的肠道组成与健康人群之间有一定的差异17。
Minerbi 表示:“我们使用了包括人工智能在内的一系列技术,以确认我们在纤维肌痛综合征患者的微生物组中看到的变化不是由饮食、药物、身体活动、年龄等因素引起的,因为我们已经知道这些因素会影响微生物。”
具体地,该研究发现纤维肌痛综合征患者与健康人之间有 19 种肠道微生物存在显著差异。其中,产短链脂肪酸的细菌在纤维肌痛综合征患者中相对丰度较低,如普拉梭菌(Faecalibacterium prausnitzii)和单形拟杆菌(Bacteroides uniformis)。
研究人员指出,普拉梭菌的减少也被发现与慢性疲劳症有关,而慢性疲劳症与纤维肌痛非常相似,而且经常并发,许多专家认为这两种疾病属于同一疾病谱系。研究人员还表示普拉梭菌这种细菌可减轻消化道的疼痛和炎症,并改善肠道屏障功能。
同时,研究人员表示:“单形拟杆菌被报道在关节炎患者中增加,可能与骨关节炎和类风湿关节炎有关。虽然纤维肌痛综合征被认为是风湿病,但是这些微生物的差异体现了纤维肌痛和关节炎之间的差异。”
除了发现这些细菌丰度差异之外,该研究还发现某些细菌的丰度同纤维肌痛症状的严重程度相关。
不过研究人员也说道:“目前,尚不清楚在纤维肌痛综合征患者中看到的肠道细菌的变化是否仅仅是该疾病的标志,还是它们确实在疾病的发病过程中起到作用。”

在纤维肌痛诊断和治疗中的意义
虽然目前还无法确定肠道微生物与纤维肌痛之间的因果关系,但是两者之间的联系已经为纤维肌痛综合征的诊断带来了新希望。
虽然 2010 年美国风湿病学会已经修改了纤维疼痛综合征的诊断标准,引入相关症状及其严重程度的评分诊断标准7,8。但是,无法否认的是目前对纤维肌痛综合征的诊断主要仍是基于主观疼痛评估进行的。而这种诊断方式与现代临床诊断标准之间存在一定距离,因此当前关于纤维肌痛综合征的诊断仍处于一种待完善的状态18。
而肠道微生物研究或会为纤维肌痛综合征的诊断带来帮助,可能能够弥补目前客观生物标志物不足的缺陷16。
此外,有关该疾病的微生物组研究也许还会给治疗带来新的思路,不过目前仍需要进一步明确肠道菌群与纤维肌痛综合征之间的因果关系:是肠道微生物的改变引起了纤维肌痛,还是疾病引起了肠道微生物的改变?
如果证实了肠道微生物确实在纤维肌痛的发病机制中起到一定的作用,那么未来我们就可以开发以肠道菌群为靶标的新治疗方法,甚至可以采用饮食疗法来缓解纤维肌痛综合征患者的症状。
无疑,这样的前景,对于患者和医生来说,都是振奋的。
参考文献:
1.Sumpton JE, Moulin DE. Fibromyalgia. Handb Clin Neurol. 2014;119:513‐527. doi:10.1016/B978-0-7020-4086-3.00033-3
2.Goldenberg DL. Multidisciplinary modalities in the treatment of fibromyalgia. J Clin Psychiatry. 2008;69 Suppl 2:30‐34.
3.Goldenberg DL, Burckhardt C, Crofford L. Management of fibromyalgia syndrome. JAMA. 2004;292(19):2388‐2395.
4.Borchers AT, Gershwin ME. Fibromyalgia: A Critical and Comprehensive Review. Clin Rev Allergy Immunol. 2015;49(2):100‐151. doi:10.1007/s12016-015-8509-4
5.Williams DA, Clauw DJ. Understanding fibromyalgia: lessons from the broader pain research community. J Pain. 2009;10(8):777‐791. doi:10.1016/j.jpain.2009.06.001
6.Jain AK, Carruthers BM, van de Sande MI et al.. Fibromyalgia syndrome: Canadian clinical working case definition, diagnostic and treatment protocols – a consensus document. J Musculoskelet Pain. 2003; 11: 3–107.
7.Wolfe F, Smythe HA, Yunus MB, et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia. Report of the Multicenter Criteria Committee. Arthritis Rheum. 1990;33(2):160‐172. doi:10.1002/art.1780330203
8.Wolfe F, Clauw DJ, Fitzcharles MA, et al. The American College of Rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity. Arthritis Care Res (Hoboken). 2010;62(5):600‐610. doi:10.1002/acr.20140
9.Clauw DJ. Fibromyalgia: a clinical review. JAMA. 2014;311(15):1547‐1555. doi:10.1001/jama.2014.3266
10.Lynch SV, Pedersen O. The Human Intestinal Microbiome in Health and Disease. N Engl J Med. 2016;375(24):2369‐2379. doi:10.1056/NEJMra1600266
11.Koh A, Bäckhed F. From Association to Causality: the Role of the Gut Microbiota and Its Functional Products on Host Metabolism. Mol Cell. 2020;78(4):584‐596. doi:10.1016/j.molcel.2020.03.005
12.Cryan JF, O'Riordan KJ, Cowan CSM, et al. The Microbiota-Gut-Brain Axis. Physiol Rev. 2019;99(4):1877‐2013. doi:10.1152/physrev.00018.2018
13.Galland L. The gut microbiome and the brain. J Med Food. 2014;17(12):1261‐1272. doi:10.1089/jmf.2014.7000
14.Yang TY, Chen CS, Lin CL, Lin WM, Kuo CN, Kao CH. Risk for Irritable Bowel Syndrome in Fibromyalgia Patients: A National Database Study. Medicine (Baltimore). 2017;96(14):e6657. doi:10.1097/MD.0000000000006657
15.Malatji BG, Meyer H, Mason S, et al. A diagnostic biomarker profile for fibromyalgia syndrome based on an NMR metabolomics study of selected patients and controls. BMC Neurol. 2017;17(1):88. Published 2017 May 11. doi:10.1186/s12883-017-0863-9
16.Clos-Garcia M, Andrés-Marin N, Fernández-Eulate G, et al. Gut microbiome and serum metabolome analyses identify molecular biomarkers and altered glutamate metabolism in fibromyalgia. EBioMedicine. 2019;46:499‐511. doi:10.1016/j.ebiom.2019.07.031
17.Minerbi A, Gonzalez E, Brereton NJB, et al. Altered microbiome composition in individuals with fibromyalgia. Pain. 2019;160(11):2589‐2602. doi:10.1097/j.pain.0000000000001640
18.Minerbi A, Fitzcharles MA. Gut microbiome: pertinence in fibromyalgia. Clin Exp Rheumatol. 2020;38 Suppl 123(1):99‐104.
作者|Gemiu
审校|617


