
编者按:
微生物组的突破性研究开辟了新的疾病治疗思路,微生物组疗法也应运而生。目前国内外企业对微生物组疗法商业领域的关注度也在不断提高。
今天,我们分享一篇由全球咨询公司 Charles River Associates(CRA)撰写的如何商业化微生物组疗法的文章。希望为产业相关人士和读者带来一些启发和帮助。
越来越多的证据表明,人体微生物组中细菌的失衡会导致一系列疾病,而恢复共生细菌可以治疗某些疾病1。微生物组与人体健康之间的这种联系,显示出微生物组作为主要治疗靶标的潜力,并已激发了多种基于微生物组的疗法,这些疗法目前正在进行临床前和临床试验2。
其中,活体生物药(用活菌恢复患者体内的共生细菌3)是最有效、最先进的方法之一。 随着几种活体生物药走向商业化,微生物组疗法市场的高增长潜力也是显而易见的。
尽管如此,仍有一些障碍,阻碍了基于微生物组的疗法的开发和商业化,以及更多公司进入该领域的意愿,包括:
1.缺乏有效地展示这些疗法临床应用效果的方法;
2.在医生的治疗方案中,尚无明确的使用指导规范;
3.该领域的起源,及其自然属性上的不确定性4,5。
当前,仅有一种针对微生物组的疗法——粪菌移植(FMT),在临床实践中广泛用于治疗复发性艰难梭菌感染(rCDI)。FMT 涉及从一个人的粪便中提取健康细菌,并将其直接转移到感染患者中6。由于微生物组与 rCDI 的病因直接相关,因此尽管没有获得美国食品药品监督管理局(FDA)的正式批准,FMT 也已被许多医疗中心广范接受,是 rCDI 患者最有效的治疗方法。
然而,也有少数报道指出 FMT 可能会对患者现有的微生物组产生负面作用,即引入了致病细菌7,8。
随着一些有前景的微生物疗法通过临床试验,药物制造商从 FMT 的缺点中汲取了教训,并积极解决利益相关者的关注点和挑战,努力为 rCDI 和其它适应症提供基于微生物组的新一代治疗方案(见图1)。
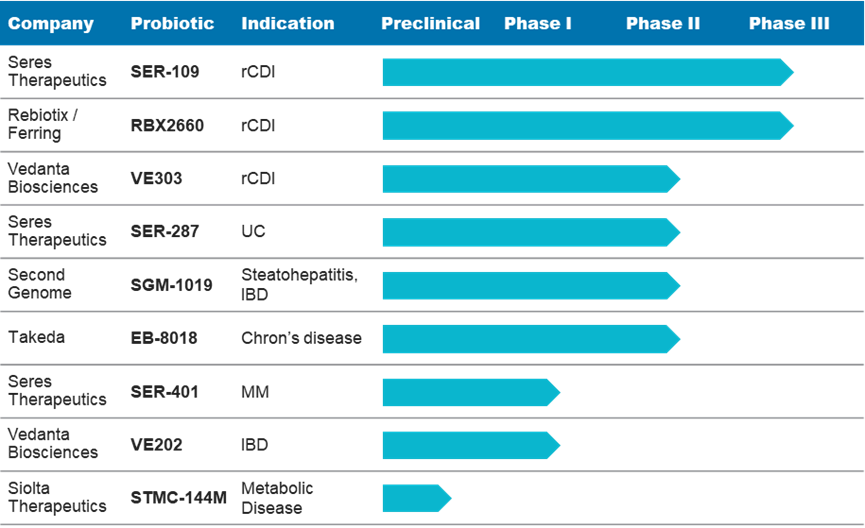 图1.基于微生物组的疗法的进展(截至2021年1月):rCDI:复发性艰难梭菌感染,UC:溃疡性结肠炎,IBD:炎症性肠病,MM:转移性黑素瘤
图1.基于微生物组的疗法的进展(截至2021年1月):rCDI:复发性艰难梭菌感染,UC:溃疡性结肠炎,IBD:炎症性肠病,MM:转移性黑素瘤
为了成功推动基于微生物组的疗法(包括正在申请监管批准的疗法)的研发和最终应用,药物制造商必须解决三个关键障碍。这些障碍的核心是说服利益相关者(从患者到医疗保健提供者再到购买人),相信微生物组疗法在改善患者预后方面的价值:
1.缺乏可靠的疗效数据和安全性数据
药物研发人员必须利用有限的临床数据,让医生相信微生物组疗法所提供的现实价值。一些医生呼吁提供更可靠的临床数据,以验证这些新兴疗法的有效性,并强调目前在微生物组操纵如何影响人类健康方面仍然缺乏共识9。
虽然一些医生同意,微生物组对某些疾病病理有重要影响,而且调控微生物组或将是解决神经退行性疾病、炎性疾病和代谢性疾病等一系列疾病的关键。但是其它人则认为,由于缺乏支持治疗用途的经验证据,因此不宜将微生物组疗法纳入治疗决策10。
2.不确定的商业机会
目前尚不清楚医生将如何在临床实践中应用微生物组疗法,因为临床试验通常表明,这些产品可用于满足一系列尚未被满足的需求。
此外,微生物组疗法可能会给制造商带来巨大的风险,尤其是开发首次上市(first-to-market)的疗法的制造商,因为这些疗法没有临床研发、监管审查或上市和营销策略的先例。制造商需要在这个尚未开发的市场中找到最大的商业机会,并收集市场支持数据,向潜在客户展示。
3.潜在客户的认知有限
由于微生物组领域的刚刚起步,许多患者和医生对微生物组疗法,及其独特的疾病治疗方法的理解和认识有限。他们通常不了解是什么要素将这些类型的疗法彼此区分开来。一旦疗法获得批准,就必须有效传达能与目标客户产生共鸣,并符合其需求的价值主张,这一点至关重要。
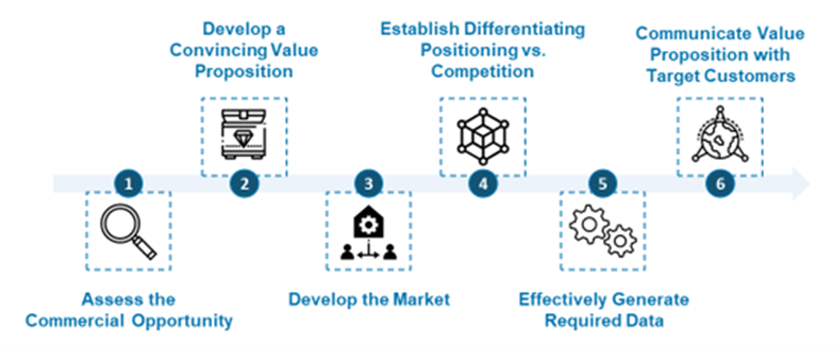 图2.开发微生物组疗法所要面临的挑战。
图2.开发微生物组疗法所要面临的挑战。
如图 2 所示,成功推动已批准的微生物组的疗法的关键是克服上述障碍,这需要说服这些利益相关者相信这项疗法的价值。
这项工作的第一步是深入了解产品的商业潜力,并确定其最具潜力的商业用途。 这将需要采用开发和利用机会评估框架,该框架应评估一系列具体的因素指标,包括:1)产品价值定位的优势;2)投入临床实践的能力;3)目标干预治疗过程中涉及的患者规模; 4)医生和患者采用的可能性; 5)竞争水平; 6)购买人的偿付能力。
1.制定价值定位
一旦制造商确定了最具潜力的商业机会,必须采取措施来重申其产品的价值定位,以确保其符合目标客户未满足的需求,可以通过提供充分的支持数据,以及与利益相关者的产生共鸣(例如 ,医生、患者和购买人)。
2.教育和竞争地位
制造商还需要更广泛地了解微生物组在诱发不同疾病中的潜在作用,以及这种疗法如何靶向微生物组发挥作用和其已证明的临床益处。这可能涉及到宣传教育和医师培训,以及开发教育资源和材料。加强对特定疗法的教育和认知工作也可以帮助将其与现有的标准护理和未来的市场参与者区分开来。
制造商须从战略层面上,考虑如何针对竞争对手,来定位治疗方案,以证明其独特的价值定位,从而支撑上市后的推广。
3.临床数据产生
在微生物组疗法获得批准和采用的道路上,也许最重要的一步是制定一个全面的战略,有效地生成监管机构所需和目标客户所青睐的临床数据。
证据的生成计划必须详细说明,制造商将如何识别与产品价值主张相关的关键数据差异(例如,患者结果、健康经济和成果研究数据),确定这些数据差异的优先级,并生成必要的数据以证实产品的临床用途、价值主张和定位。
执行有效的证据生成策略会涉及一系列活动,包括回顾性声明分析、前瞻性图表研究和其他临床试验。最成功的微生物组疗法制造商将以负担得起和便利的方式执行这些活动。
4.交流价值
收集所需的临床数据后,制造商必须与目标客户沟通产品的价值。这可能包括获取产品的实际购买人或医生对产品的评价,培训销售团队以解决医生提出的问题或疑虑,为潜在患者创建 FAQ 资源以及开发购买人预算影响模型。
无论采取何种策略,都应针对每个客户的产品和需求量身定制策略,以确保工作具有针对性和成本效益,并确保价值主张与目标利益相关者产生共鸣。

新兴微生物组疗法的成功开发和商业化的协调需要战略性地执行这些策略,由具有临床开发和创新技术商业化经验的专家支持,并确保在上市后获得客户的认可。活体生物药(包括潜在的治疗方法)的成功启动将取决于建立强有力的价值主张,围绕该主张和定位建立强有力的支持证据,以应对当前和未来的激烈竞争。如果这些关键驱动因素到位,它将促进新型益生菌在这个令人兴奋的新领域中发展,并获得未来几年的高增长潜力。
参考文献
(滑动下文查看)
1.de Vos, W. M., & de Vos, E. A. (2012, August 1). Role of the intestinal microbiome in health and disease: from correlation to causation. Nutrition Reviews, 70(1), S45-S56.
2.Wischmeyer, P., McDonald, D., & Knight, R. (2016). Role of the microbiome, probiotics, and ‘dysbiosistherapy’ in critical illness. Current Opinion in Critical Care, 22(4), 347-353.
3.Vanderhoof, J. (2017, March). 147 Early changes in the human Microbiome alter immune function and immunologically mediated disorders. Journal of Animal Science, 95(2), 69-70.
4.Marks, L. (2018, March). The human microbiome. What Is Biotechnology.
5.Ghaisas, S., Maher, J., & Kanthasamy, A. (2016, February). Gut microbiome in health and disease: Linking the microbiome–gut–brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases. Pharmacology & Therapeutics, 158, 52-62.
6.Group, M. T. (2019). Microbiome Therapeutics Innovation Group Statement on Safety Alert Regarding Use of Fecal Microbiota for Transplantation and Risk of Serious Adverse Events Likely Due to Transmission of Pathogenic Organisms. Retrieved from MTIG.
7.Wong, A., & Levy, M. (2019, June). New Approaches to Microbiome-Based Therapies. mSystems.
8.FDA. (2016, March). Enforcement Policy Regarding Investigational New Drug Requirements for Use of Fecal Microbiota for Transplantation to Treat Clostridium difficile Infection Not Responsive to Standard Therapies. Retrieved from Food and Drug Administration.
9.Adolph, T., Grander, C., Moschen, A., & Tilg, H. (2018, May). Liver-microbiome axis in health and disease. Trends Immunology, 39(9), 712-723.
10.Tilg, H., & Moschen, A. (2015, May). Food, immunity, and the microbiome. Gastroenterology, 148(6), 1107-1119.
原文链接
https://www.europeanpharmaceuticalreview.com/article/151507/how-to-overcome-barriers-in-the-adoption-of-microbiome-based-therapies/
作者|Andrew Thomson,Brian Carpenter & Robert Broadnax
编译|萌萌依
审校 | 617
编辑 | 笑咲


