编者按:
2020 年 12 月 21 日,国内著名英文期刊 Protein & Cell 与热心肠研究院合作,成功举办了“Protein & Cell 人类微生物组专刊线上论坛”活动。今天我们特别整理发布来自宾夕法尼亚大学医学院肿瘤学系助理教授金橙橙的演讲视频及图文实录,希望能助你涨知识。

大家好,我叫金橙橙,是宾夕法尼亚大学佩雷尔曼医学院的癌症生物学和微生物学助理教授。很高兴今天能有机会与大家分享我们以及其他团队的一些研究发现,了解肿瘤微环境中的不速之客——癌症中的微生物组。
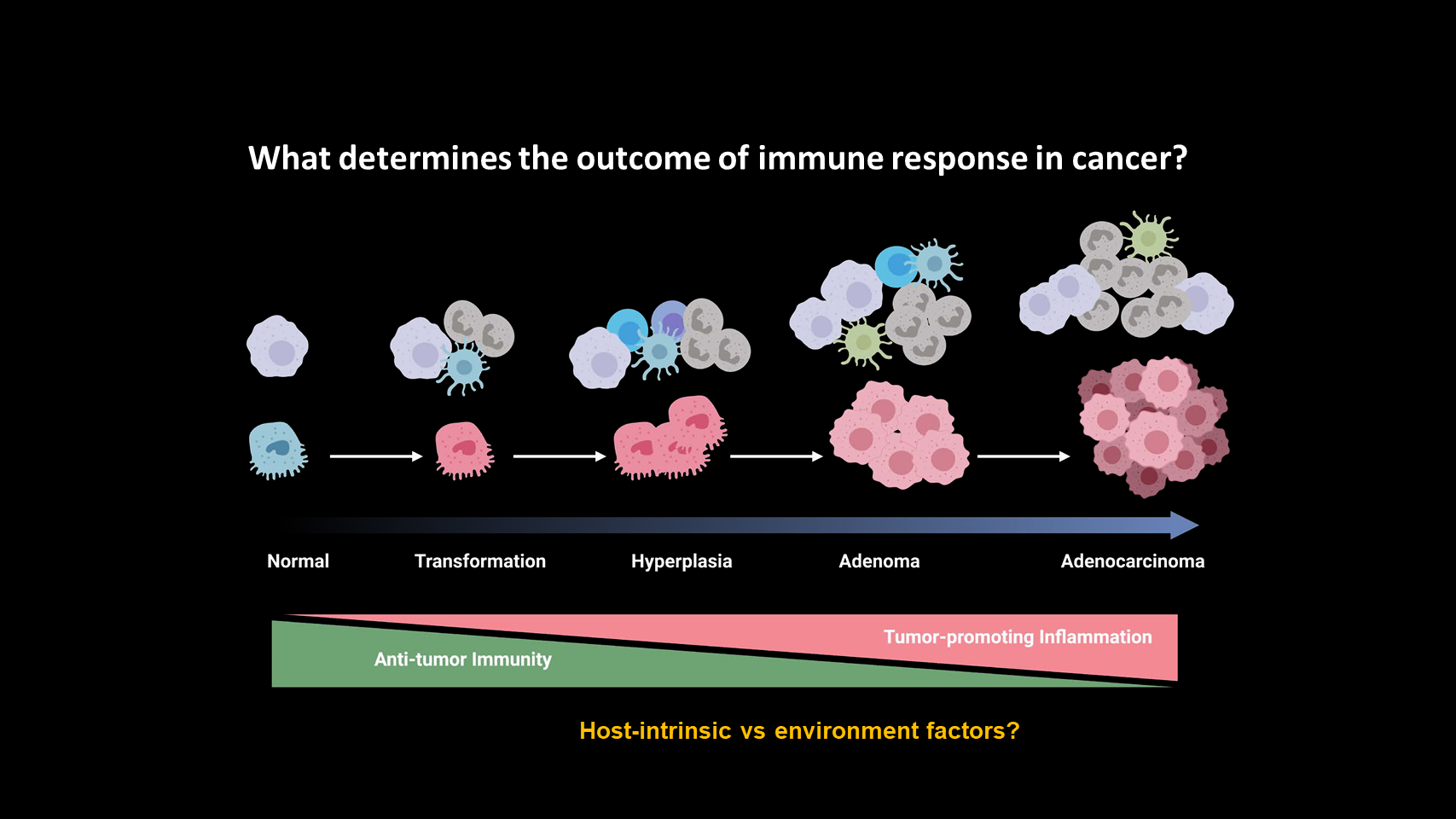
随着肿瘤的出现和发展,我们知道,不仅癌细胞内的基因发生改变,同时还存在着失调的免疫反应。大家都知道,免疫系统对癌症发展起着至关重要的作用,然而,目前我们仍未能完全理解,肿瘤相关的免疫反应最初是如何开始的,又是如何随着时间推移发生演变的。
一些宿主固有因素和外在因素已被证明能够调节肿瘤相关的免疫反应。但关键问题在于,为什么免疫系统非但不能杀死肿瘤细胞,反而会促进肿瘤生长?
因此,我们研究的首要目标是,了解宿主固有因素或环境因素是如何主导免疫反应使之趋向促肿瘤炎症而非抗肿瘤免疫,以及我们如何靶向宿主免疫系统来治疗癌症。
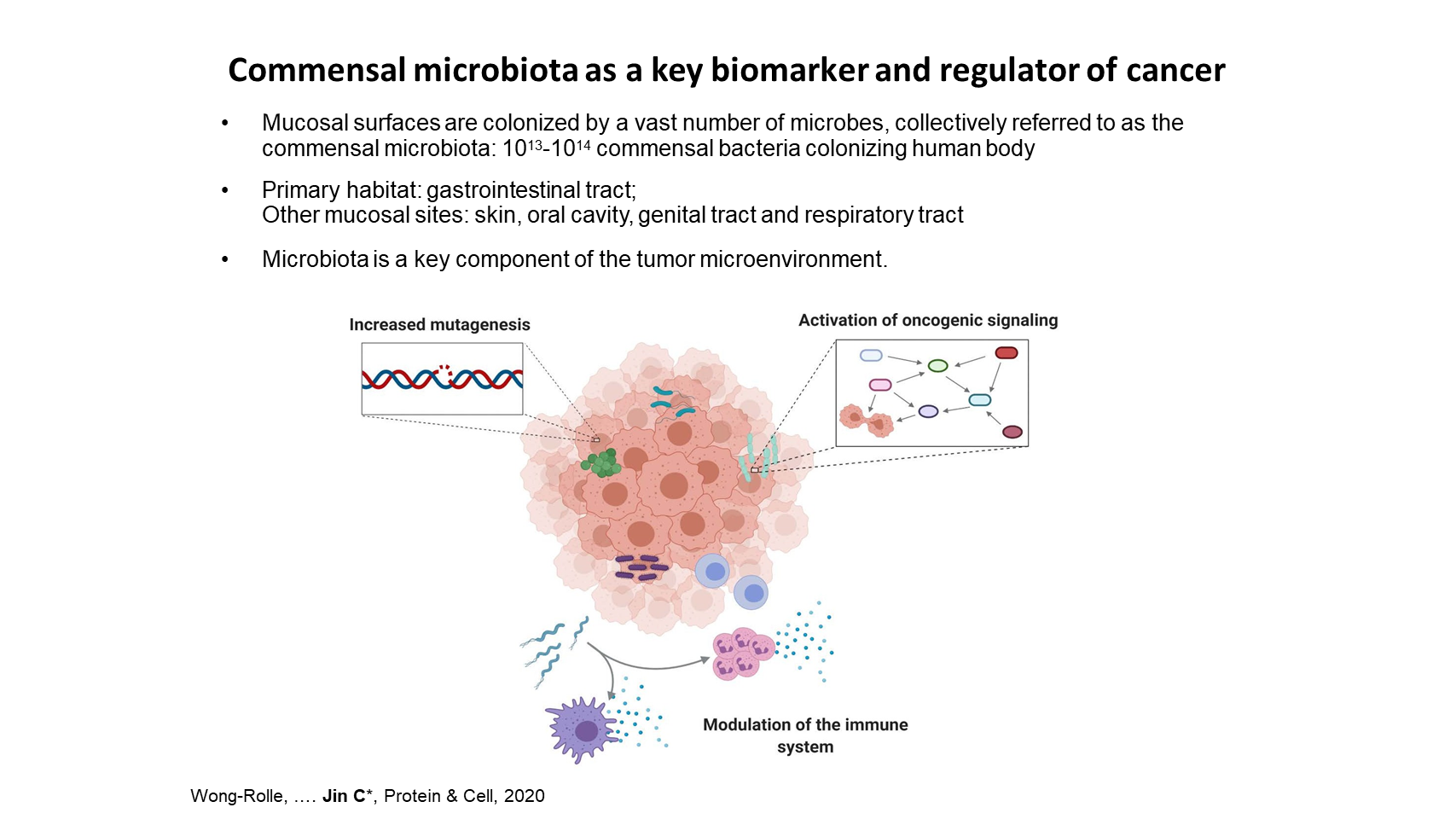
需要特别注意的是,黏膜组织中的共生菌群已成为癌症发展和治疗反应的重要的生物标志物和调控因素。
实际上,最近的一些研究表明,肠道菌群可以强力地促进多种胃肠道癌症的发生和发展,包括结直肠癌、胃癌和胰腺癌。机制上,共生细菌可以通过增加上皮细胞的基因突变或激活特定致癌途径,来直接促进癌症的发展。此外,菌群可以强力地调节宿主免疫系统,从而间接地影响肿瘤生长。
然而,大多数研究都局限于肠道菌群,我们对菌群在其他黏膜位点中的作用却知之甚少。
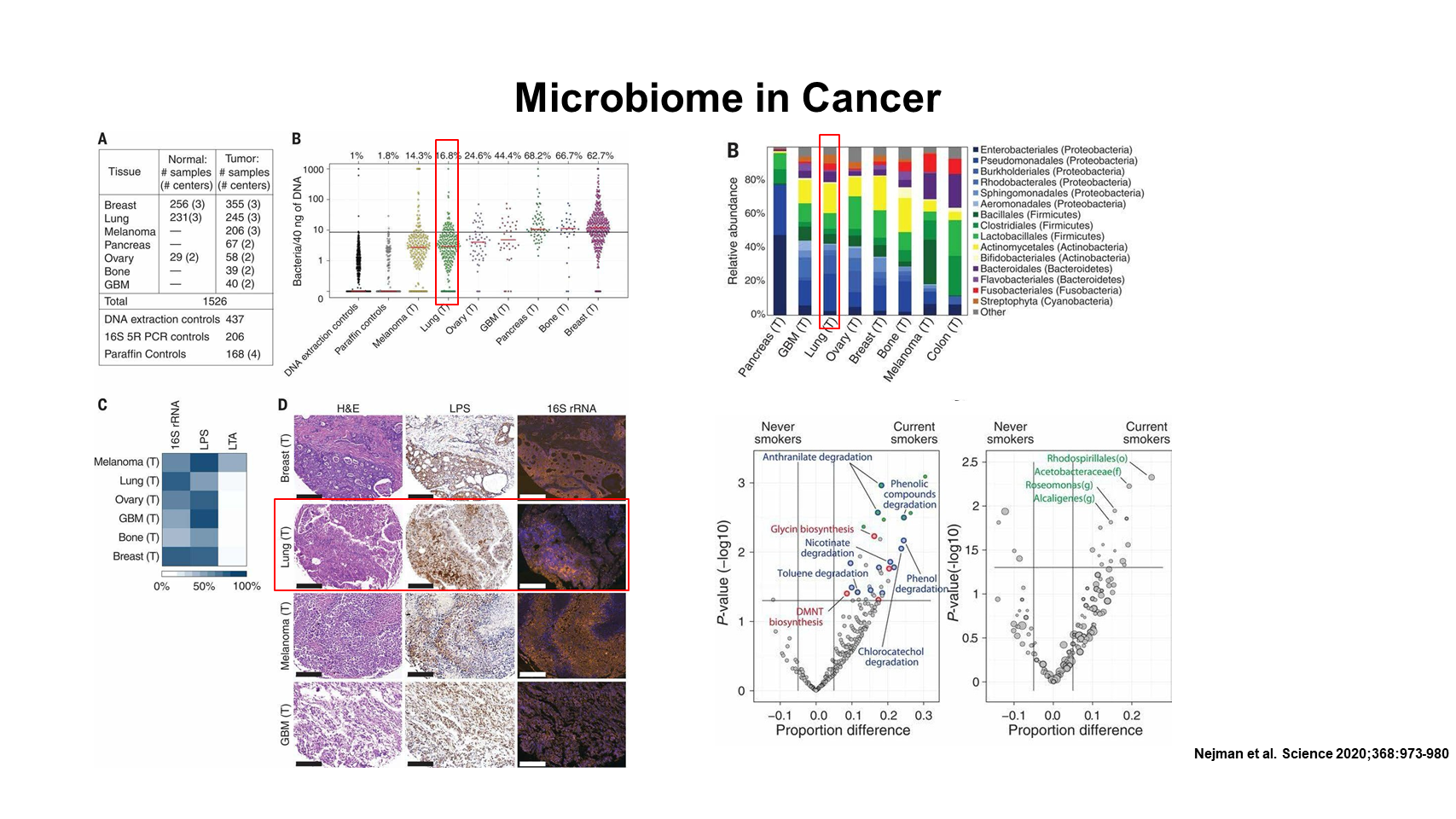
有意思的是,在最近《科学》杂志发表的一项研究中,Nejman 等人分析了 7 种癌症中的 1500 个肿瘤,发现各种癌症的肿瘤内和细胞内都普遍存在着菌群,而且肿瘤相关菌群的组成在不同癌症之间存在着明显差异。他们的进一步分析,揭示了微生物代谢途径与临床特征之间的相关性。

因此对我们而言,我们研究的主要重点是气道黏膜中的宿主-菌群的相互作用。
我们对这方面很感兴趣,因为肺是一个非常独特的黏膜器官,其表面积在人体中是最大的。通过吸入气体,肺部暴露于许多空气微生物中,在健康和疾病状态下,肺部都定殖着非常多样化的细菌群落。
许多研究表明,在哮喘、慢性阻塞性肺病和囊性纤维化等呼吸道疾病中,都存在与疾病相关的肺部细菌群落失调。
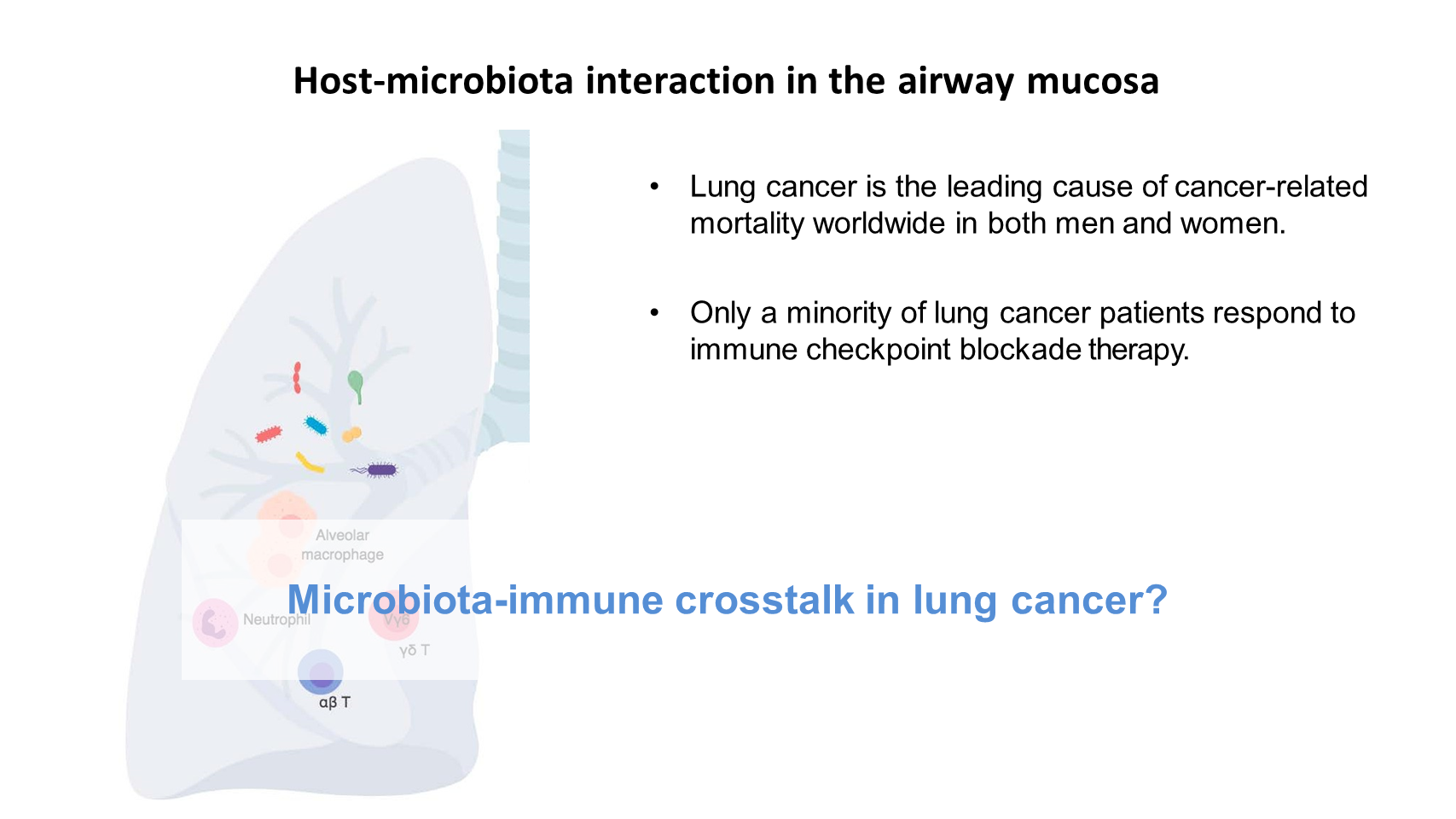
我们对肺癌特别感兴趣,因为肺癌是全球男性和女性患癌死亡的一个主要原因。肺癌的发病率和死亡率都很高,但目前的疗法实际上只对少数肺癌患者有效果,包括免疫检查点阻断疗法。因此,我们想要解决的问题是,菌群与免疫的交互作用在肺癌中扮演什么角色。
为了回答这个问题,我们使用了一个非常简洁、完善的遗传工程肺腺癌小鼠模型(KP 小鼠)。在这个模型中,向气管内递送表达 Cre 重组酶的病毒载体,会在肺上皮细胞中诱导促癌的 Kras 基因表达,并使肿瘤抑制基因 p53 缺失,导致肺组织中肺腺癌的形成和发展。
这些基因工程小鼠模型不仅准确地重现了人类肺腺癌的遗传和生理特征,与皮下移植瘤模型相比,这种模型也提供了与实际情况非常接近的生理环境——因为它的肿瘤是在原生肺部环境中从头形成的,完全受到局部的肺部菌群以及远端的肠道菌群的影响。
我们使用这一模型得到了很多有趣的发现。
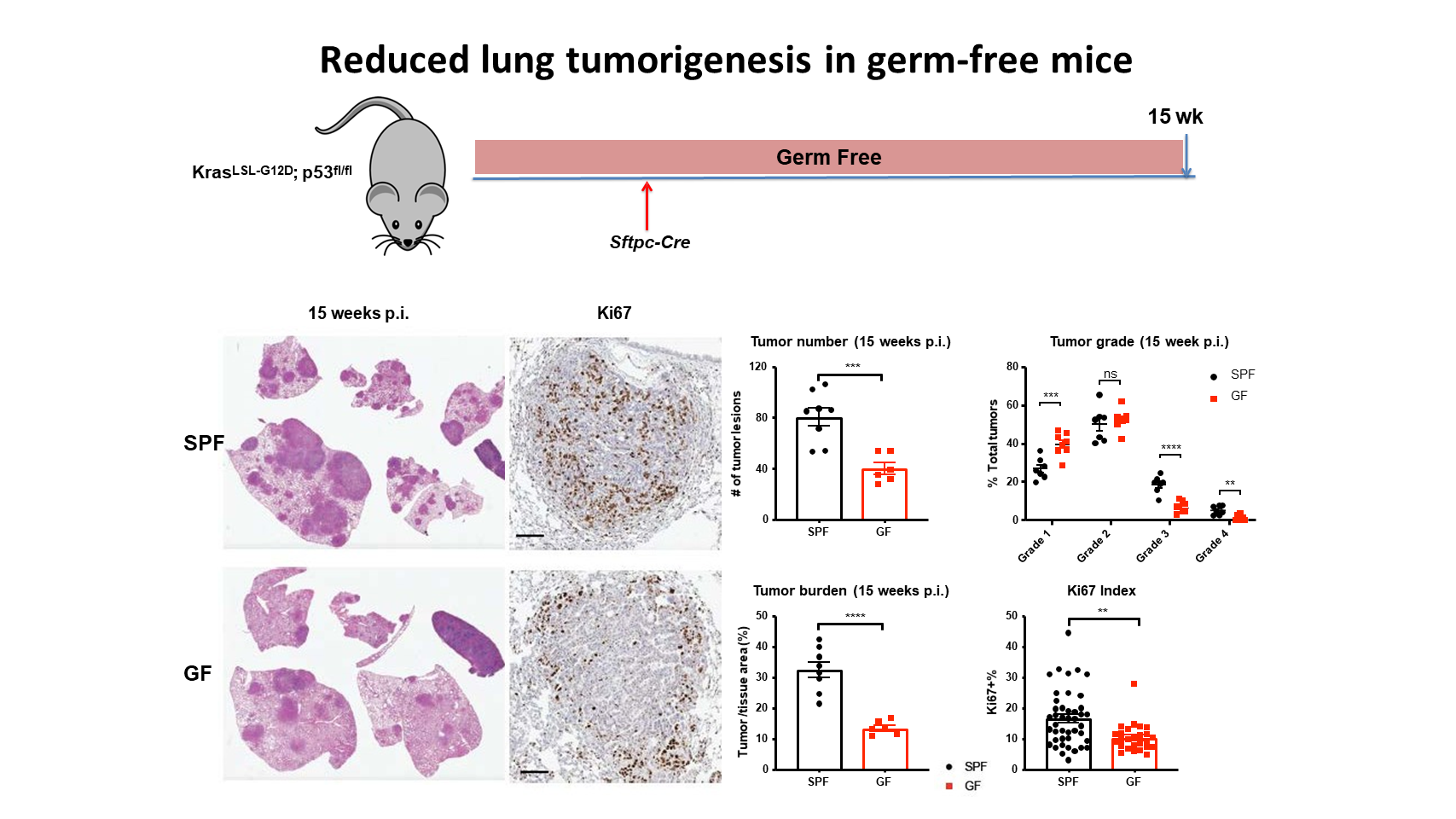
首先,为了研究菌群在肺癌发展中的功能重要性,我们将这种 KP 小鼠模型无菌化,可以看到,我们获得了一个惊人的表型。
在比较无菌小鼠与正常的 SPF(无特定病原体)小鼠的肺癌发展时,我们发现,无菌小鼠对抵抗肺癌有保护作用。与 SPF 小鼠相比,无菌小鼠的肿瘤数量较少,肿瘤负荷较轻,而且高肿瘤分级的病灶也明显较少。
在细胞水平上,我们发现,无菌小鼠体内肿瘤进展较慢,实际上是因为在无菌条件下肿瘤细胞增殖减少。

另一方面,当我们将无菌小鼠与 SPF 小鼠同笼饲养,用常规的共生菌群来定植这些无菌小鼠时,我们可以恢复这些原先无菌的小鼠的肿瘤生长。这表明,我们在前面一张幻灯片中看到的表型确实是由共生菌群所驱动的。
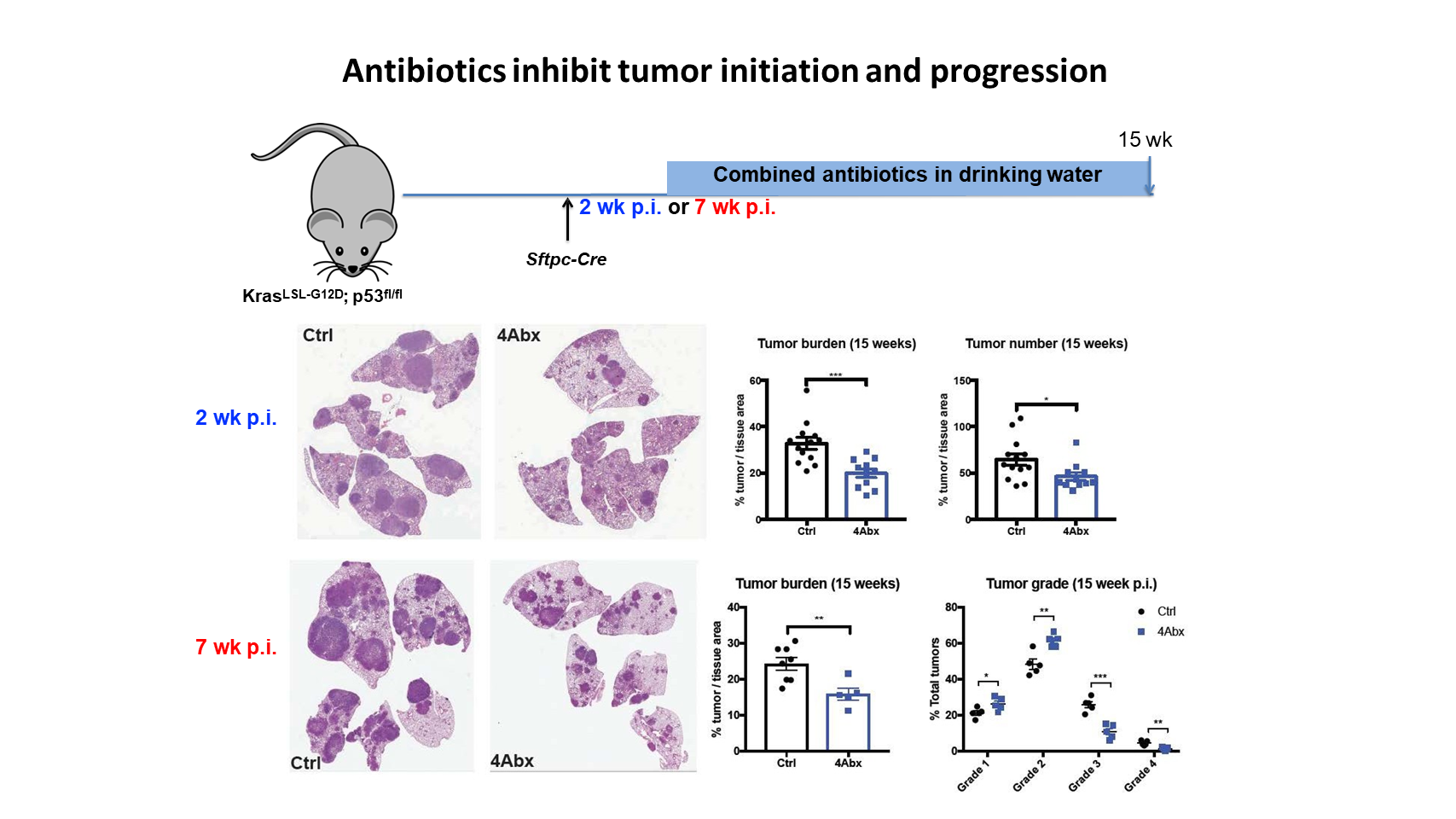
我们还用了另外一种方法,通过向小鼠饮水中加入混合抗生素来耗竭小鼠的菌群。我们发现,这种抗生素联合治疗在癌症早期和晚期都能有效地抑制肿瘤生长,从而显著减少肿瘤负荷和高分级肿瘤病灶。
因此,结合在无菌小鼠模型中的发现,这些结果表明,在由 Kras 活化和 p53 缺失诱导的肺癌发生发展中,共生细菌起着非常重要的促进作用。
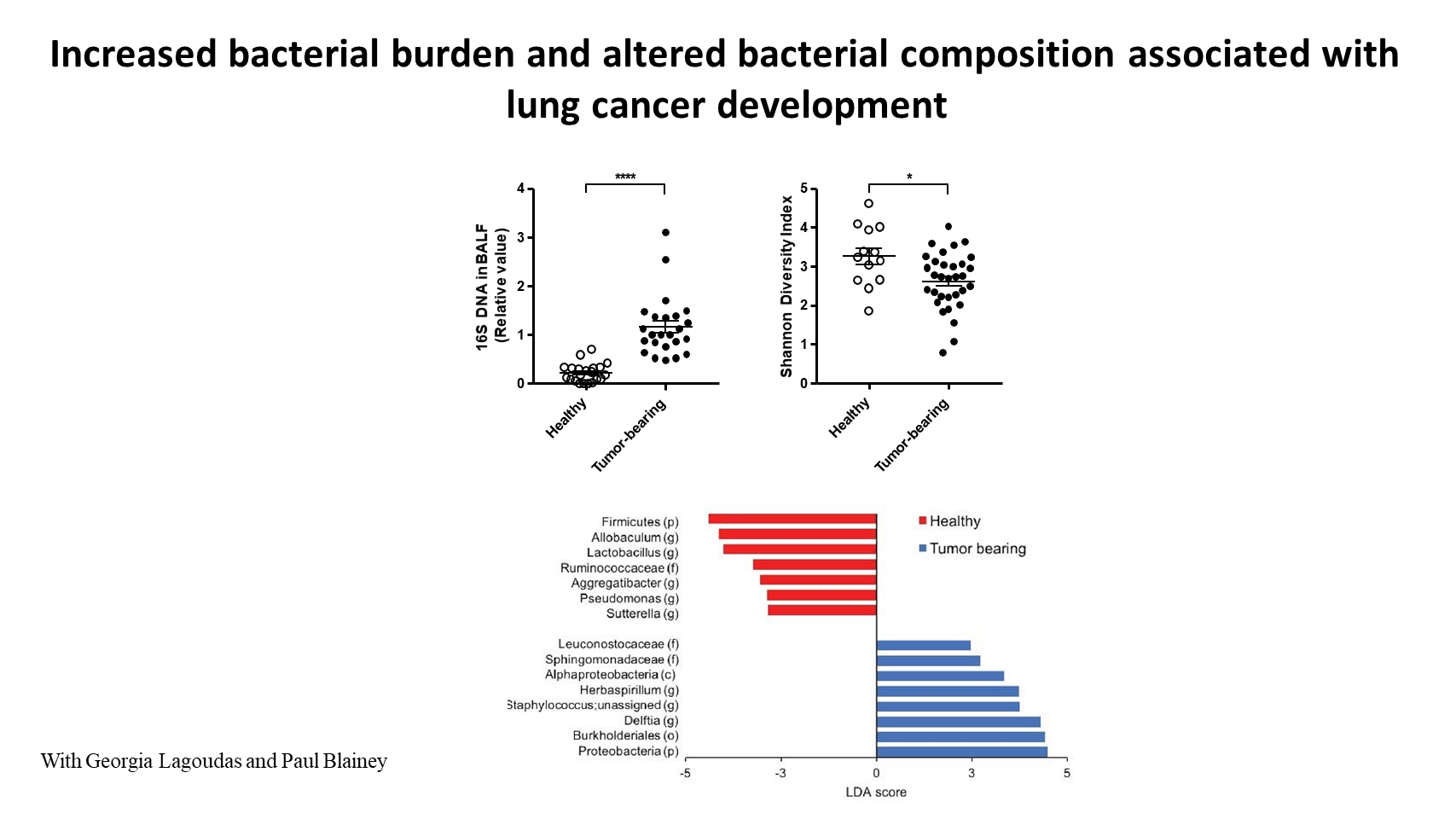
值得注意的是,我们发现,肺癌的发生与气道载菌量的急剧上升相关,我们通过测量支气管肺泡灌洗液的 16S RNA 含量得出了这个结果。
此外,我们通过测序分析发现,与健康肺相比,荷瘤肺中细菌群落的 α-多样性显著减少。同时,与健康组织相比,荷瘤组织特异性富集了某些类型的细菌。
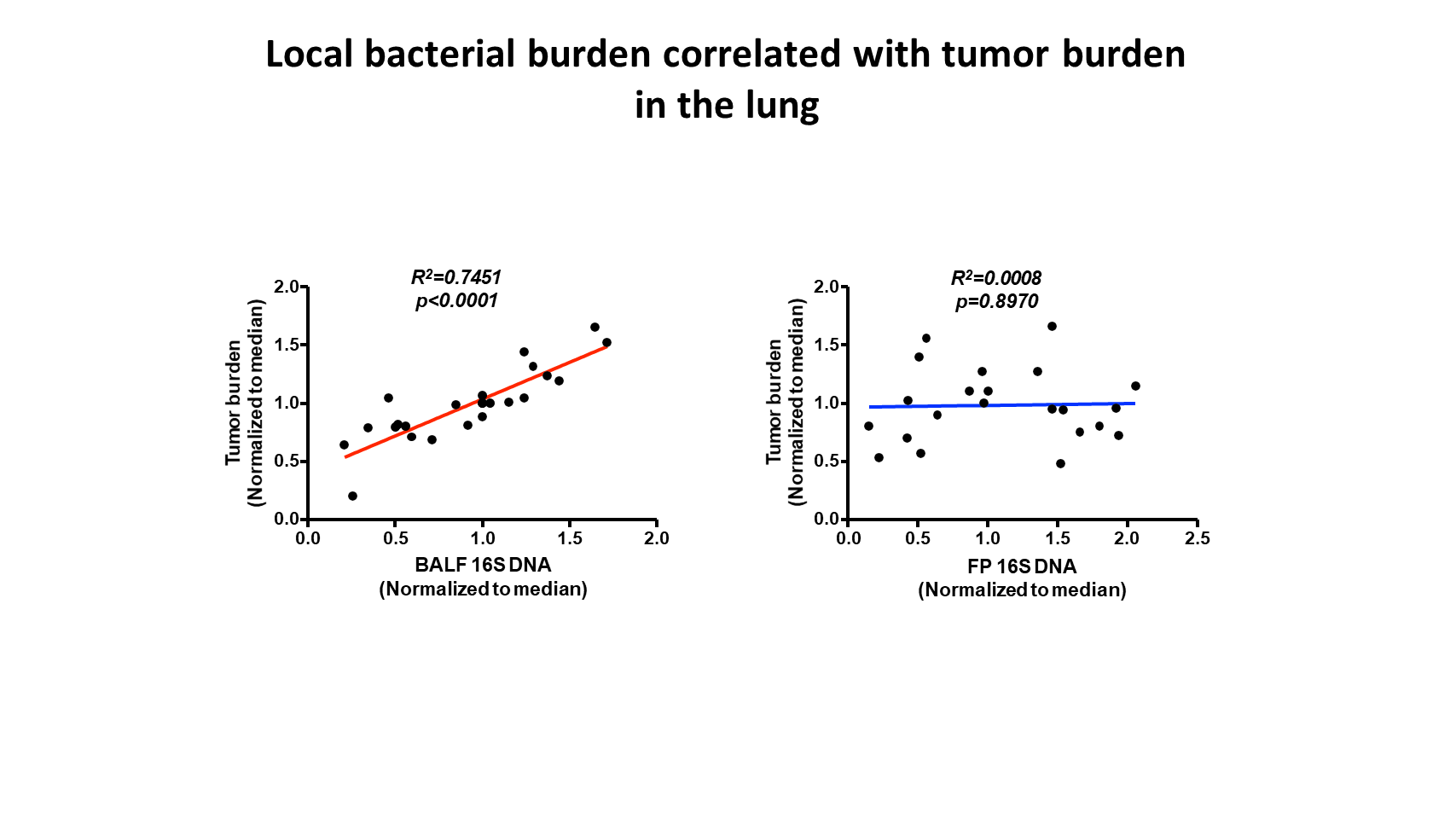
特别重要的是,菌群与肿瘤发展之间的相关性是局部的。在用抗生素消除部分共生细菌的小鼠中,我们发现,肺中的局部细菌载量而非粪便细菌载量,与肺中的肿瘤大小显著相关。
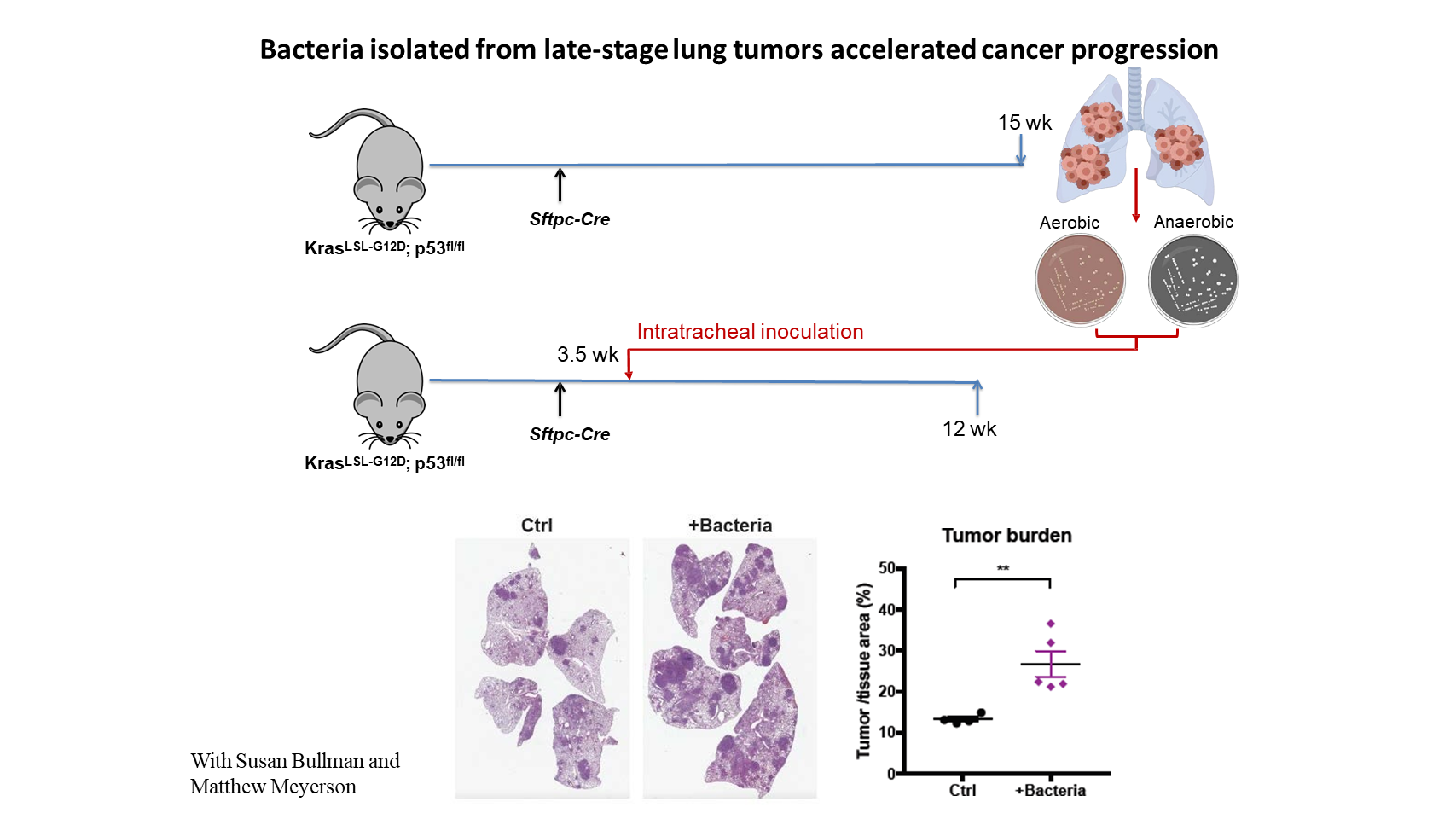
此外,我们还从 SPF 小鼠的晚期肺肿瘤中分离并培养出多种细菌。我们将这些细菌通过气道内接种,定植到另一组 KP 小鼠中。我们发现,给予这些晚期肿瘤相关细菌,能够显著加速小鼠的癌症进展。
综上所述,这些实验结果证明,肺部局部菌群在促进肺癌发展中发挥重要作用。
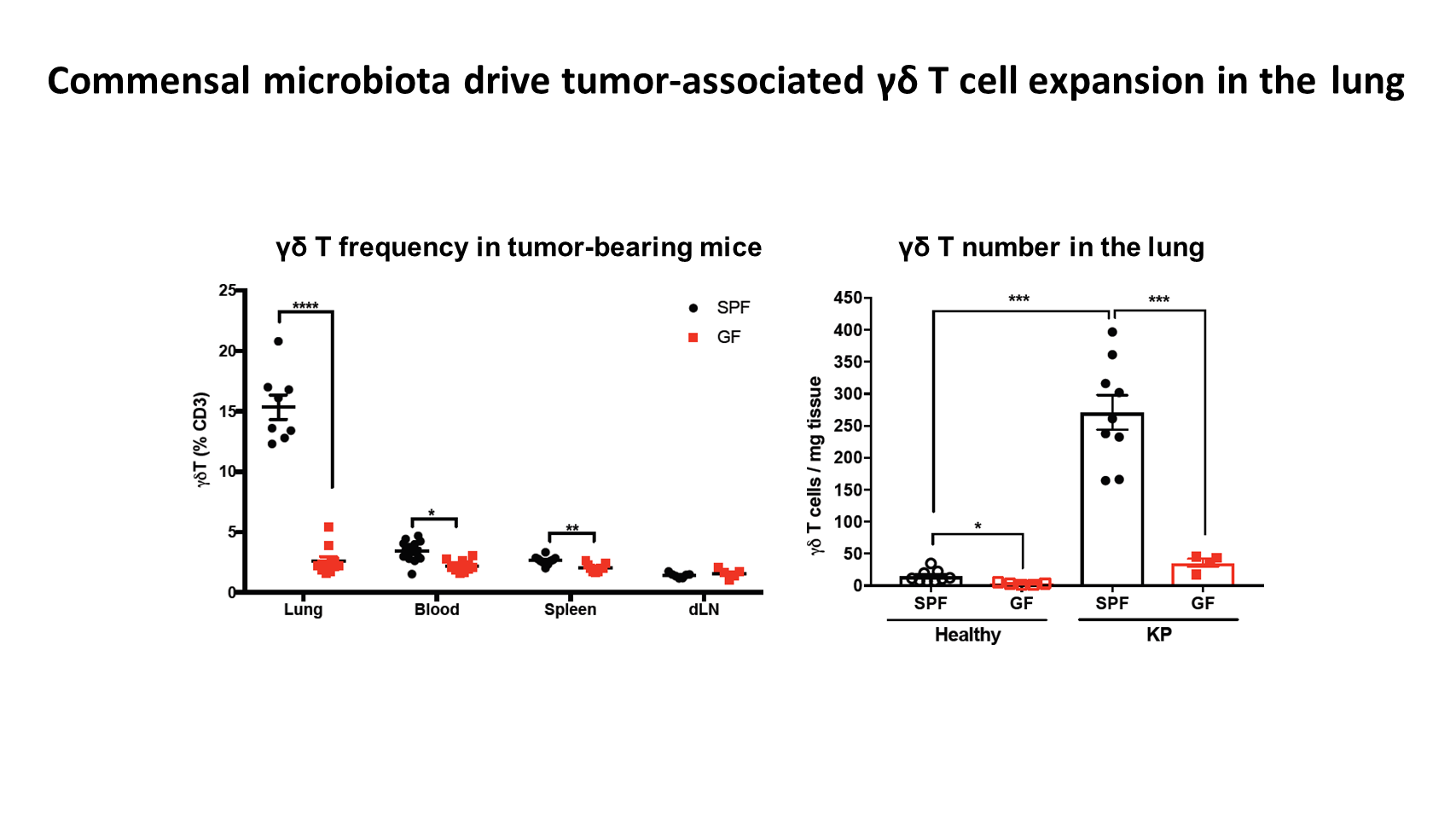
为了了解失调菌群促进肿瘤发展的机制,我们分析了 SPF 小鼠和无菌小鼠的荷瘤肺中的免疫细胞谱。
可以看到,与健康肺相比,荷瘤 SPF 小鼠中的 γδ T 细胞浸润增加了 10 倍。实际上,这些细胞在荷瘤肺的 T 细胞中的占比多达 20%。然而,这种 γδ T 细胞的扩张在无菌动物中大幅减少。
这一结果表明,共生菌群可以强力地驱动肿瘤相关 γδ T 细胞在肺部的扩增。
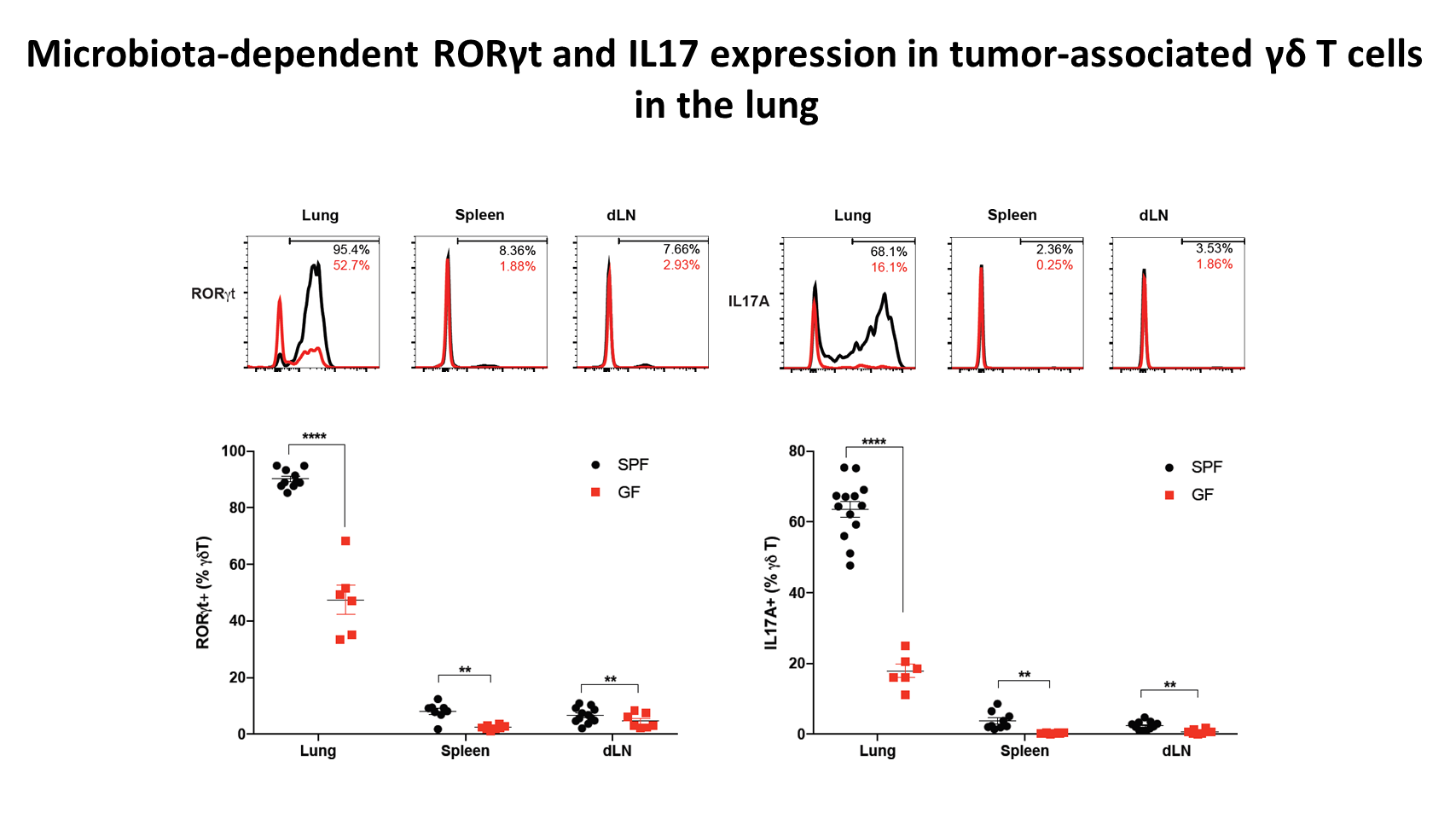
我们进一步研究了这些肿瘤相关的 γδ T 细胞的转录因子和细胞因子的表达情况。我们发现,SPF 小鼠中 90%的肿瘤相关 γδ T 细胞表达转录因子 RORγt,并且表达高水平的促炎细胞因子 IL17A。但是在无菌状态下,RORγt 的表达和 IL17 的生成都大幅减少。
这表明,菌群不仅在驱动 γδ T 细胞的数量积累中发挥重要作用,对于促进肿瘤相关 γδ T 细胞的功能分化也起着重要作用。
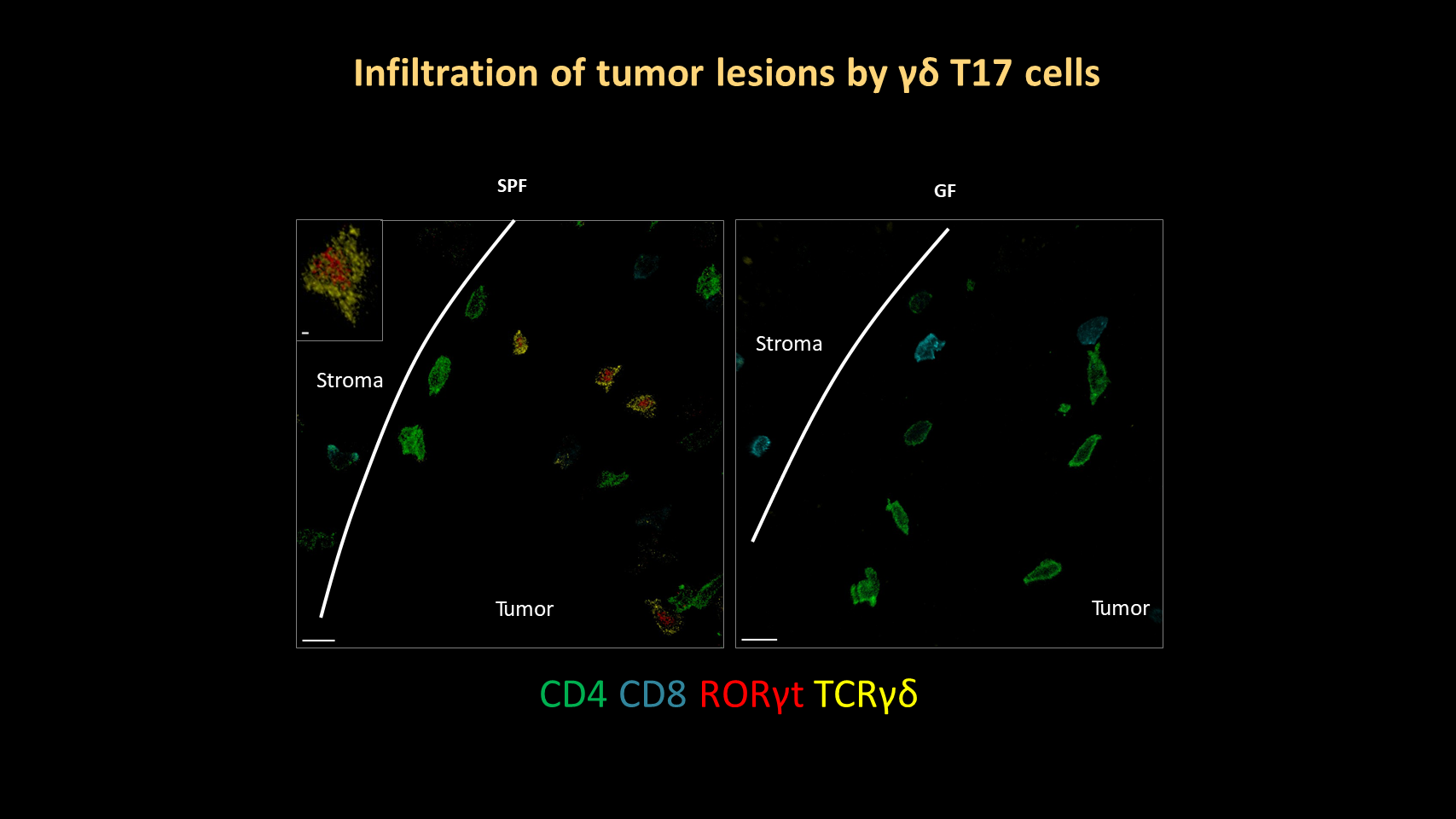
通过免疫荧光染色,我们可以进一步确认,在 SPF 状态下,肺肿瘤病灶处被 RORγt 阳性的 γδ T 细胞浸润;而在无菌小鼠的肿瘤病灶处,这些细胞基本不存在。
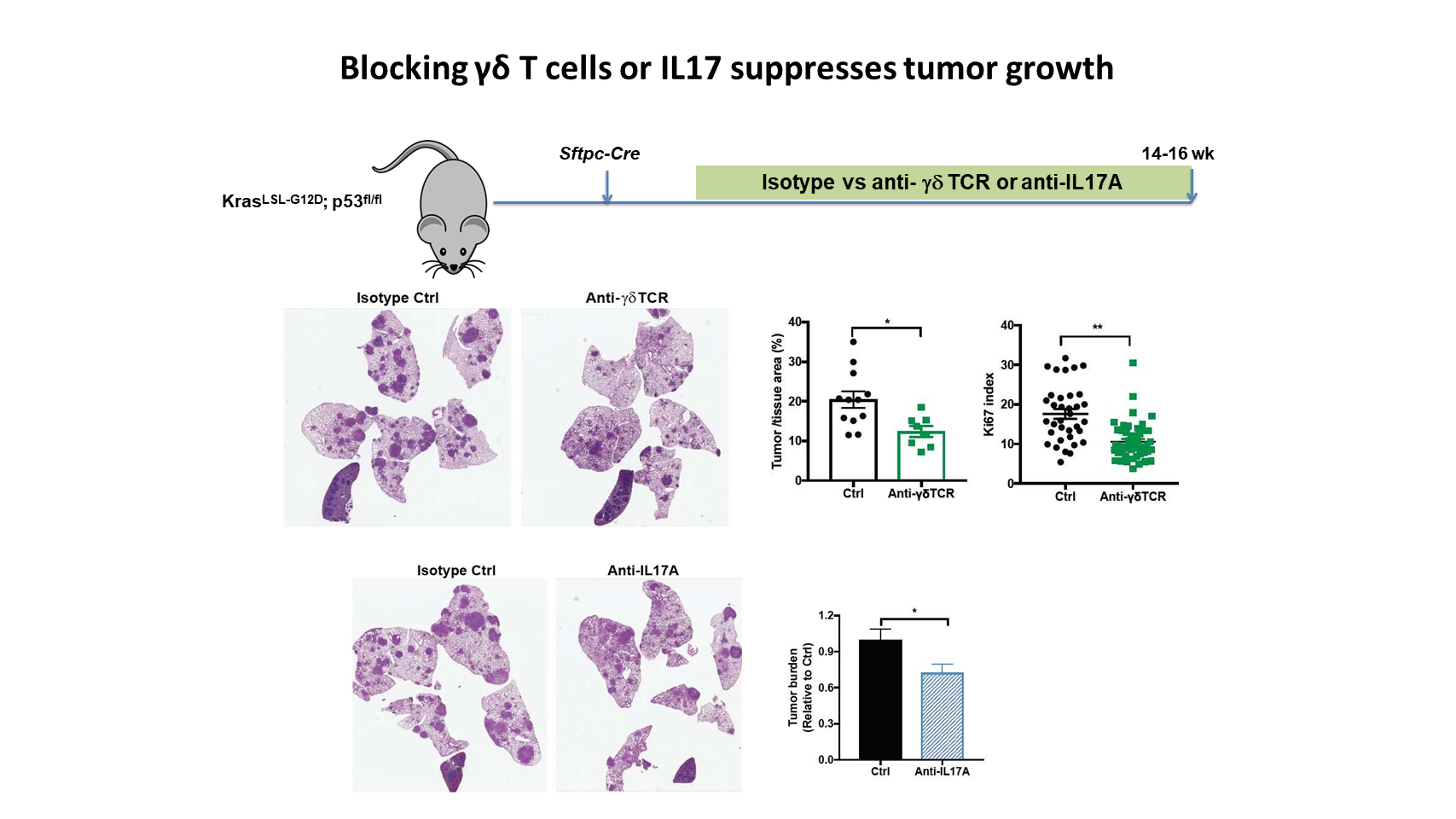
为了评估在依赖于菌群的促瘤作用中 γδ T 细胞和 lL17 的功能重要性,我们用抗 γδ T 细胞或 IL17 的单克隆抗体,在 KP 小鼠的肿瘤发展过程中对其进行治疗。结果表明,这两种疗法均可以有效抑制肿瘤生长和肿瘤细胞增殖。
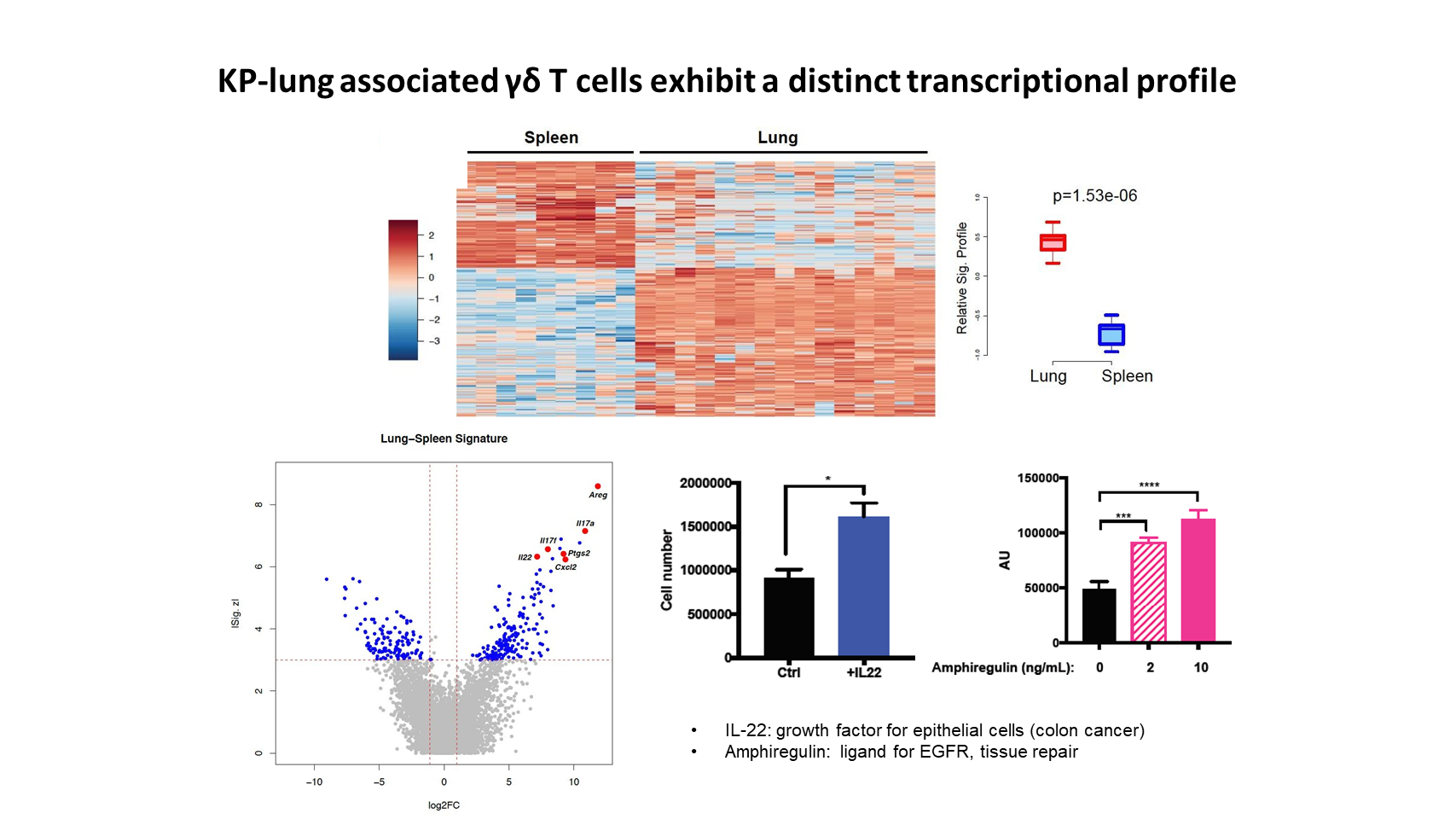
为了进一步理解肿瘤相关 γδ T 细胞的效应机制,我们使用 RNA 测序来表征其转录谱,揭示出其不同于脾脏 γδ T 细胞的独特的基因表达特征。
在上调程度最高的基因中,我们发现,除了 IL17 以外,还有几种效应分子也在肺癌相关 γδ T 细胞中高度表达,包括 IL-22 和双调蛋白。有意思的地方在于,这两种效应分子在体内外都能有效刺激肺上皮细胞或肿瘤细胞的增殖。这说明,菌群激活的 γδ T 细胞还可以通过直接作用于肿瘤细胞,来促进肺癌的进展。
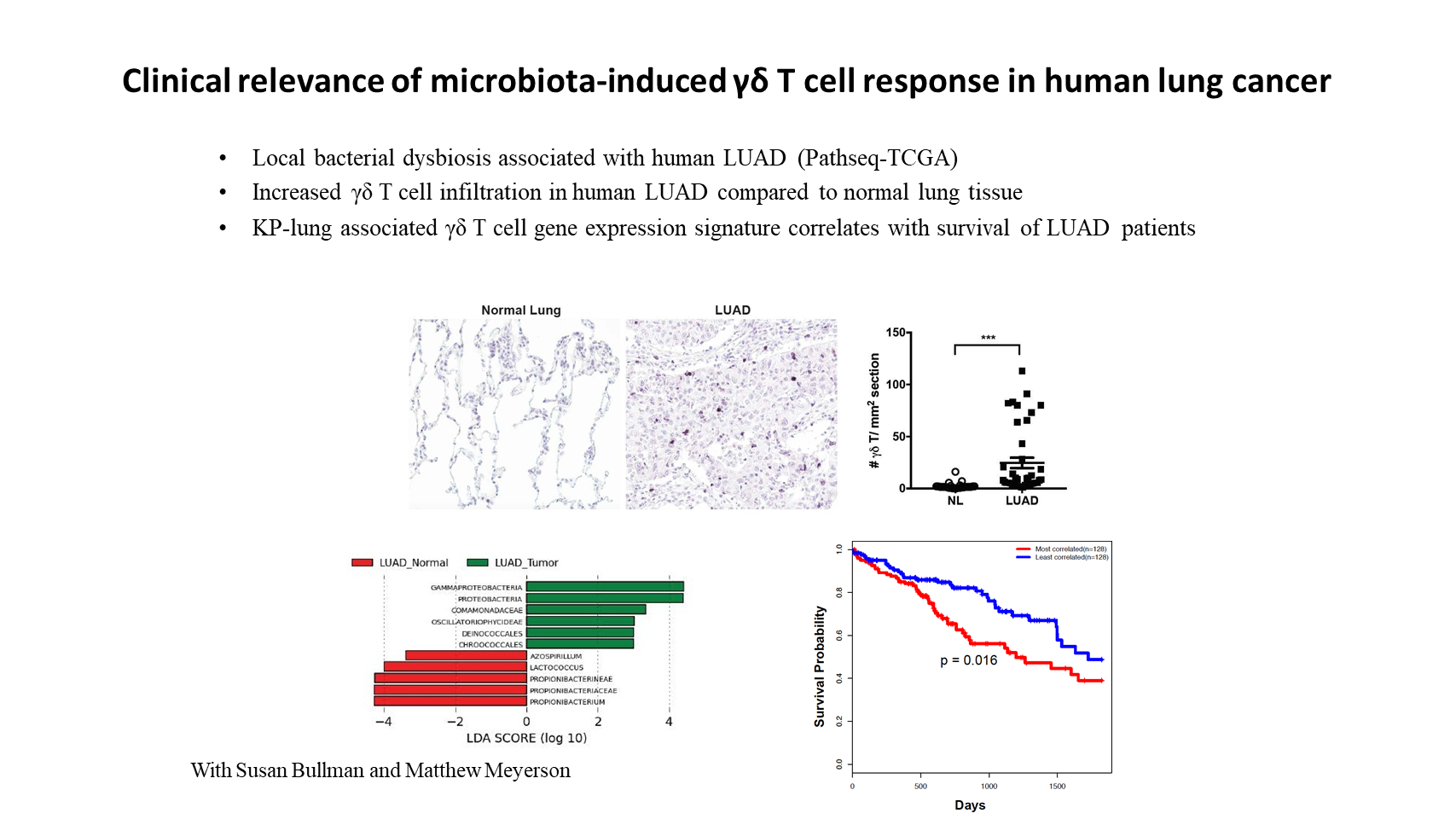
最后我想说的是,我们在小鼠模型中的发现与人类肺癌是有相关性的。
与 KP 小鼠模型的研究发现相一致的是,Pathseq 分析显示,在 TCGA 队列的人类肺腺癌中同样存在菌群失调的情况。通过免疫组化染色,我们同样观察到,与正常肺组织相比,γδ T 细胞在人肺癌病灶处的浸润情况也明显增多。
当我们使用 TCGA 数据库的 RNA 测序数据进行基于基因表达模式的患者评分,并检查其与模型小鼠的 γδ T 细胞特征的相关性时,我们发现,与不存在这种相关性的患者相比,基因表达模式与小鼠 γδ T 细胞基因表达相关度较高的患者存活率较低。这表明,从 KP 小鼠模型得出的 γδ T 细胞基因表达特征对于肺癌患者具有预后预测价值。
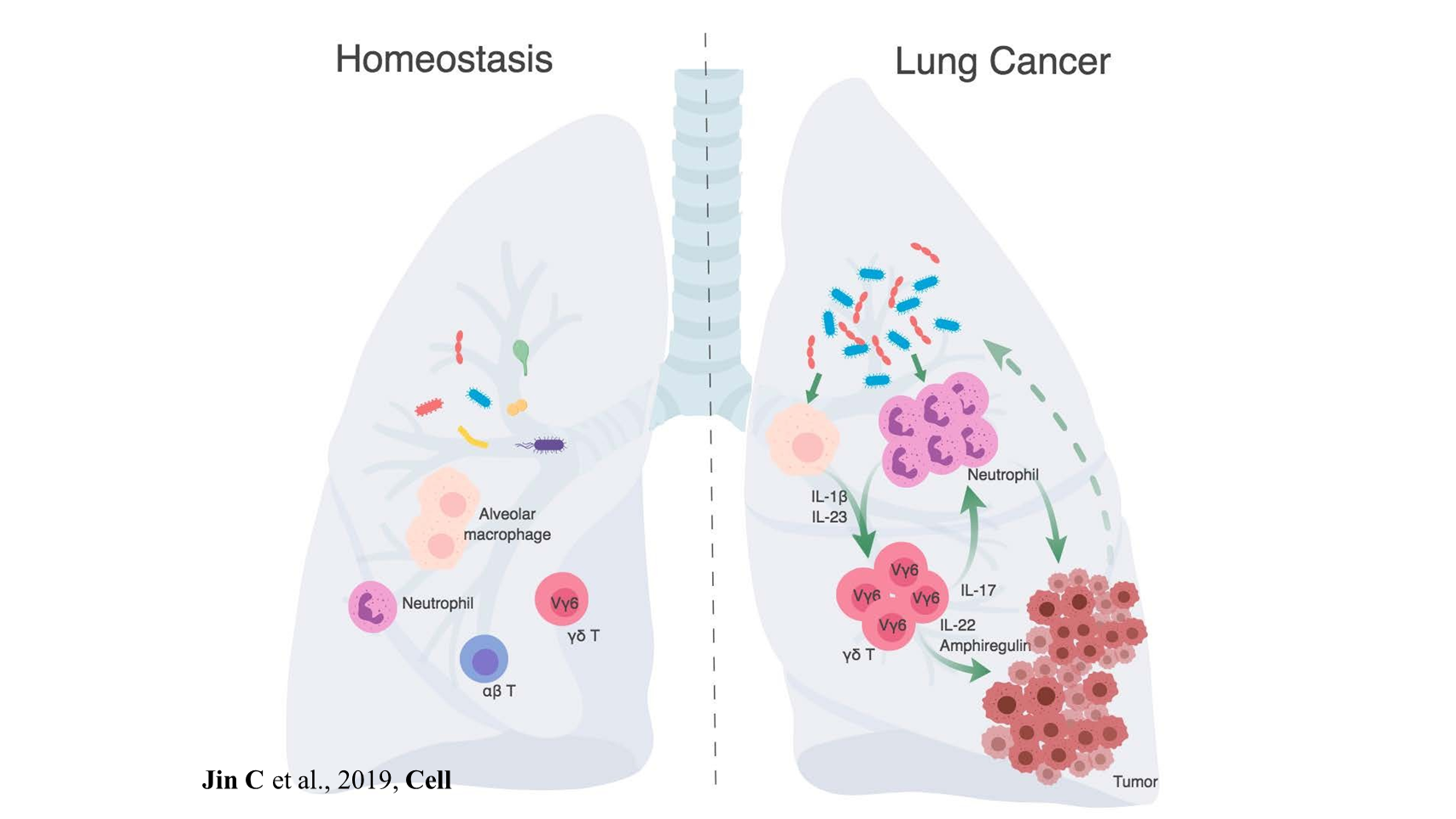
综上,我们认为,稳定状态下的肺部存在着多样的细菌群落。然而,在肺癌发生的情况下,肿瘤的生长会引起局部菌群失调,从而导致细菌载量总体增加和细菌种类的改变。
随后,失调的菌群可以触发下游免疫激活,包括活化髓系细胞生成 IL-1β 和 IL-23。这些因素进一步激发了 γδ T 细胞的活化和增殖。随后,这些活化的 γδ T 细胞再进一步生成细胞因子 IL-17,促进中性粒细胞的浸润;它们也会产生其他因子,如 IL-22 和双调蛋白,直接驱动肿瘤细胞增殖。
这些作用共同形成了促进癌症进展的恶性循环。
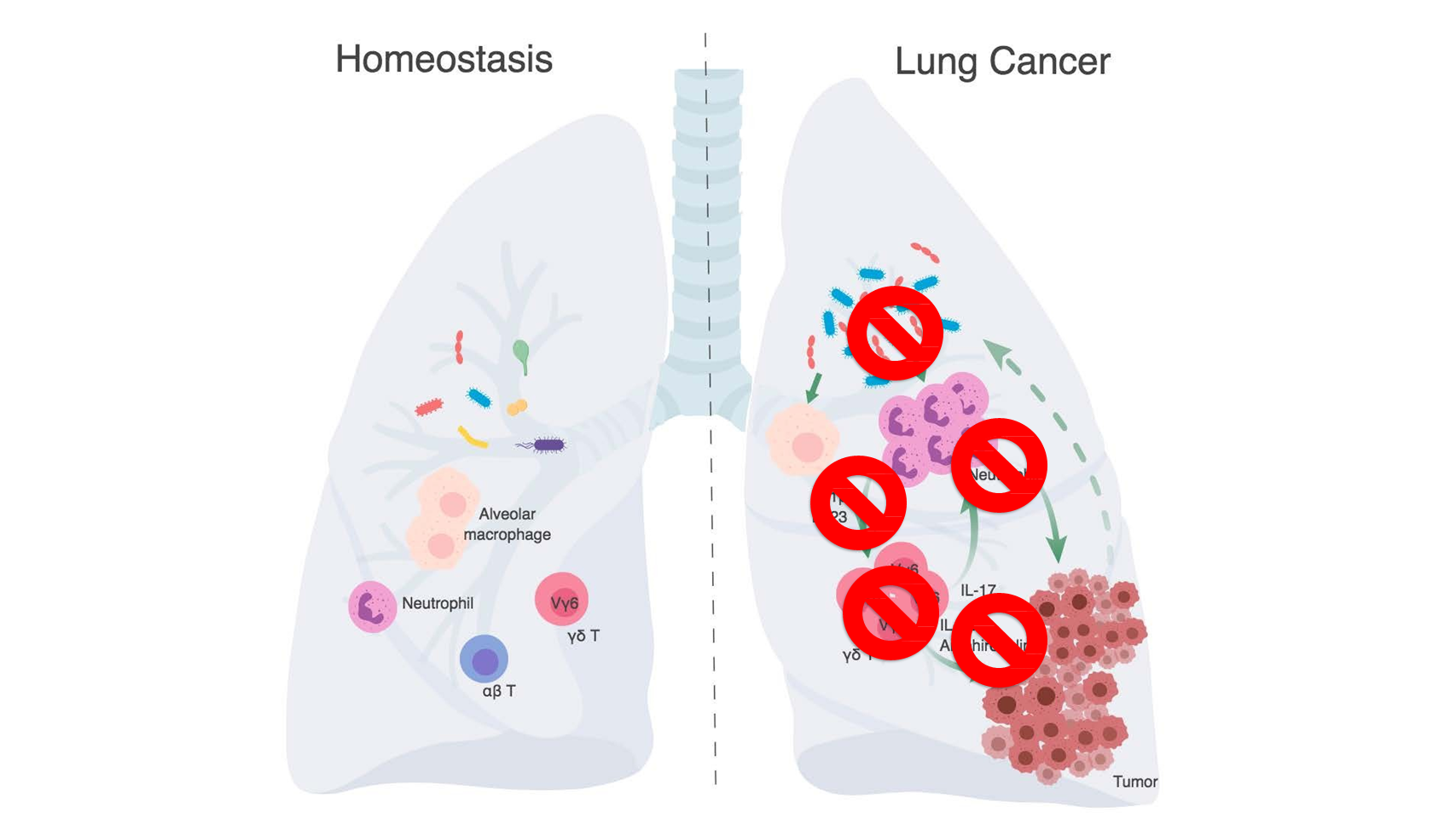
基于这一模型我们认为,如果我们能够特异性靶向肿瘤相关菌群或者被这些细菌激活的下游免疫通路,我们就有可能找到可以更有效治疗肺癌的方法。
最后,我想提一下,除了我们的研究以外,多项临床证据已将肺部菌群与癌症联系起来。
早期的流行病学研究表明,肺癌病例中普遍存在细菌感染的情况。实际上,多达 70%的肺癌患者会被某种细菌感染。这类被称为“阻塞后肺炎”的疾病,会对肺癌治疗和患者整体存活率产生负面影响。通过先进的高通量测序技术,越来越多的研究表明,局部菌群失调与肺癌之间存在关联。
这里我们总结了一份近期的研究清单(详见演讲视频),列示了在肺癌中检测到的不同类型的细菌。虽然癌症样本中发现的具体细菌类别,在不同研究中可能因样本类型、取样方法和患者群体而异,但这些研究都一致表明,肺癌与局部菌群失调相关,这种失调的特征是细菌总体丰度增加和细菌组成改变。
我们的研究强调了菌群在驱动促肿瘤炎症中的重要作用,其他机制也可能参与肺部菌群在肺癌中的功能。
例如,先前研究的证据表明,局部菌群可能会影响抗肿瘤免疫,或者上调癌细胞中某些致癌通路的活性。我们从肠道菌群的研究中可以了解到,失调的肺部菌群产生的某些代谢物也可能影响肿瘤生长。
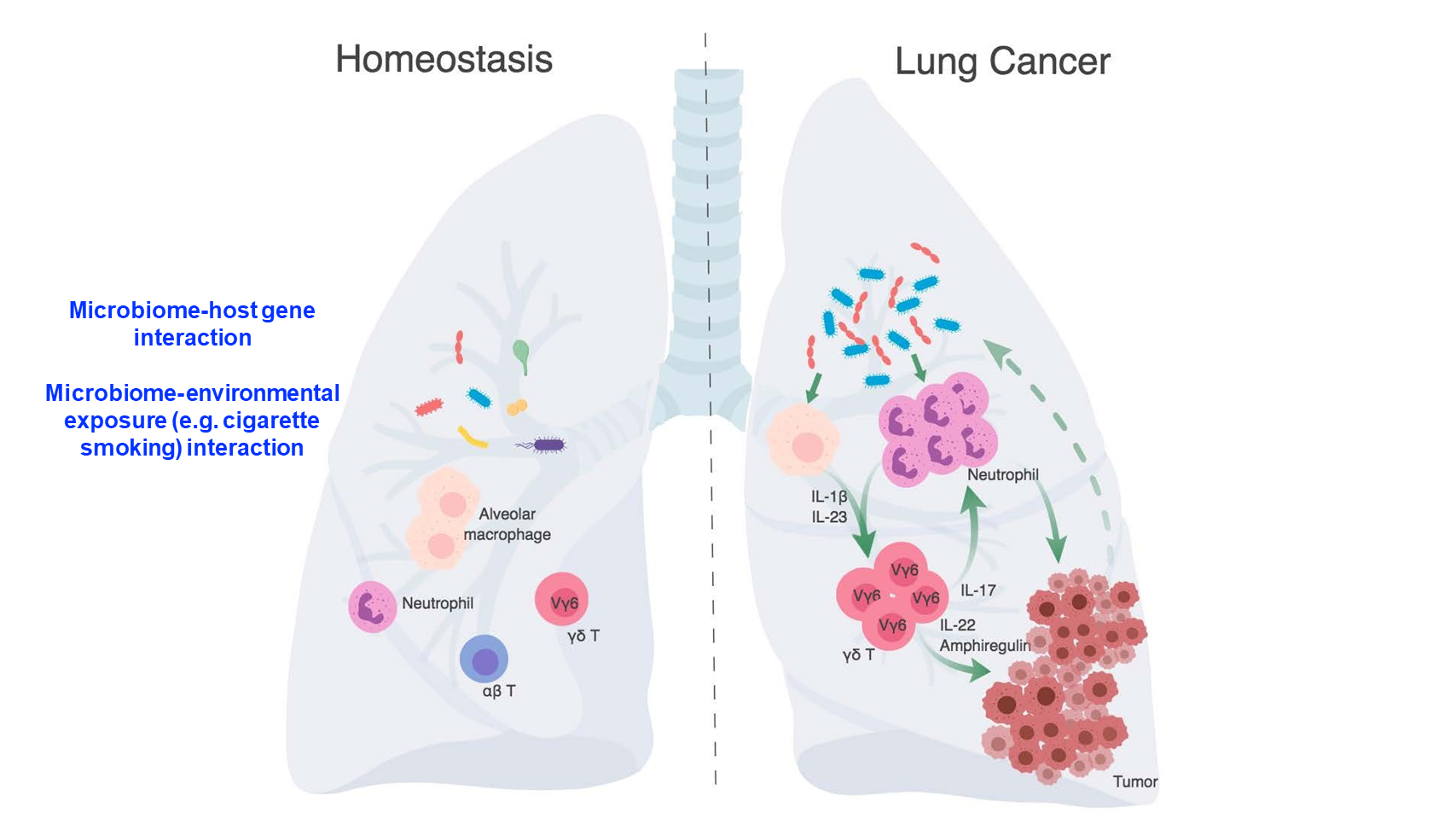
我认为,未来该领域需要进一步研究的重要问题,就是宿主基因型和环境暴露如何塑造菌群。同时我们也想了解,菌群如何反过来影响癌症发展和治疗反应。
为了实现这一目标,我们结合使用基因工程小鼠模型和多种最新技术,包括多组学、先进的成像技术、基于 CRISPR-Cas9 的基因编辑工具以及单细胞测序,以解决癌症中宿主与菌群相互作用的基本问题。

在此,我要感谢我在麻省理工学院做博后的 Jacks 实验室,我也要感谢我的实验室成员,他们为这项研究做出了巨大贡献。
感谢聆听!


