
编者按:
微生物组疗法正在蓬勃发展,许多初创公司都已经启动了相关的临床试验。然而,微生物组疗法想要真正商业化,除了要解决生产工艺等方面的困难,还面临着专利申请方面的挑战。
今天,我们特别翻译了近期发表在 Nature Biotechnology 杂志上的关于微生物组疗法专利申请的文章,该文介绍了微生物组疗法的产业现状和在申请专利保护时所面临的挑战。希望本文能为相关的产业人士和诸位读者带来一些帮助。
微生物组疗法
学术期刊上稳步增多的论文数量表明,人体微生物组在健康和疾病方面的重要性已经在科学领域内被广泛认可1,2。另外,还有大量面向大众读者的微生物组治疗相关的读物不断被出版3,4。
医学研究表明,基于微生物组的干预手段可以追溯到 4 世纪的中国,在当时,医生利用粪便悬浮液治疗传染性胃肠道疾病5。
近年来,人们又再次开始关注粪菌移植(fecal microbiota transplantation, FMT),开始使用这一方法治疗炎症性肠炎(inflammatory bowel disease, IBD)6和艰难梭菌感染(Clostridium difficile infections, CDI)7。
FMT 提供的临床数据、关于微生物组与免疫应答间联系的证据以及测序技术的进步,不仅推动了微生物组疗法的发展8~10,同时也促使微生物组相关的专利迅速增加(图 1)。
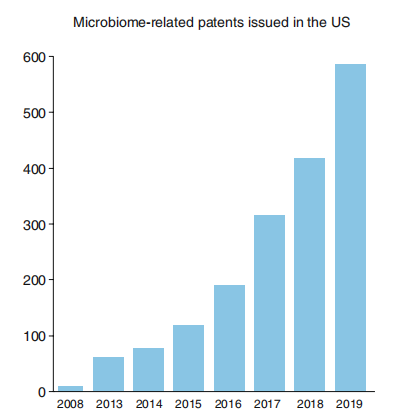
图 1. 美国颁发的专利中注明“microbiome”或“microbiota”的专利数量。
微生物组疗法可以从多个维度进行分类,包括生物学概念、治疗领域或“微生物状态(bug status)”。
在这些分类方法中,“微生物状态”对微生物组公司的定位是最有用的。微生物组公司主要可以分为三类:“来源于微生物的药物”、“针对微生物的药物”或者“微生物作为药物”。
第一类“来源于微生物的药”,遵循传统药物的开发步骤,微生物是其治疗方法的来源。这样的治疗方法包括由微生物组中的细菌分泌的生物活性分子在内的代谢物和其他组分。属于这一类的公司有 Enterome、Second Genome 和 Kintai Therapeutics。
第二类“针对微生物的药物”涉及对细菌“食物”的管理。因此,这类“药物”的出现打破了已获批的治疗方法和公认安全(generally recognized as safe, GRAS)的成分之间的明确界限。属于这一类的公司有 Kaleido Biosciences,该公司生产可以促进某些细菌生长的修饰后的聚糖。
第三类“微生物作为药物”包括对一种或多种微生物的控制。这类微生物疗法带来了特殊的专利申请挑战,将是我们在本文中论述的重点。
微生物作为药物治疗成分包括微生物
将微生物作为一种治疗方法的理论基础是早期益生菌相关文献。此外,研究发现微生物组的失调与疾病状态相关,还发现 FMT 或可治疗某些疾病6,7。
“微生物作为药物”的治疗方法也叫做活体生物疗法(live biotherapeutic products, LBPs),这是美国食药监督局(FDA)使用的术语。
LBP 遵循 FDA 的生物制品许可证申请批准流程。虽然一些 LBP 已经进展到 III 期临床实验,但是截止到 2020 年 4 月,FDA 还没有批准任何 LBP 作为针对人类疾病的治疗方法。
LBP 可以根据 LBP 的复杂程度和特性分为几个亚类。图 2 显示了 LBP 微生物组疗法按照复杂性和特性进行的分类,并列举了一些具有代表性的公司。
LBPs 中最复杂的一类是以 FMT 为基础的疗法,此类疗法的具体特性还没有完全研究清楚;
第二类是多菌株活体疗法,所有不止一种菌株的活体疗法都属于这一类别;
LBP 的第三类是单菌株活体疗法。
在本文中,我们将仅讨论由细菌菌株组成的组合物,这些组合物涵盖了目前临床研究中的大部分微生物组治疗方法。除此之外,实际上,由非细菌微生物(例如噬菌体、真菌和病毒)组成的微生物组疗法也正在开发中。
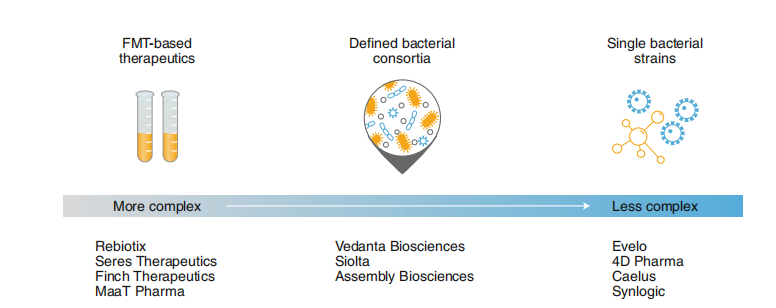
图 2.“细菌作为药物”类别
基于FMT的疗法
FMT 是指将从一个个体(供体)中得到粪便,转移到另一个个体中(患者或接受方)。FMT 通常使用的是预先冷冻的粪便,然后通过鼻胃管插管、口服胶囊或灌肠等方式到达作用部位。
在美国,研究人员如果想要采用 FMT 治疗疾病需要向 FDA 提交新药临床(IND)申请,除了以下这种情况:使用 FMT 治疗对标准疗法无效的 CDI,FDA 会行使执法自行决定权,无需 IND 申请,仅需要病人的知情同意。
基于 FMT 的治疗方法需要分析并剔除供体粪便中的致病菌。
由于基于 FMT 的治疗方法利用的是捐献者的粪便,所以难以阐明这种疗法的特性。尽管如此,目前依然有多家初创公司正在研发基于 FMT 的治疗方法。
其中之一是来自 Rebiotix 公司的灌肠产品 RBX2660。该产品在治疗复发性 CDI 的 II 期临床实验中被证明是有效的,II 期临床试验是一项随机、双盲、安慰剂对照试验。目前,该产品的 III 期研究已经在进行中,结果可能会在 2020 年发布。
Finch Therapeutics 公司正在研发 CP-101,这是一种由冻干粪便物质组成的口服剂,目前正在进行治疗 CDI 的 II 期临床实验,结果预期会在 2020 年年中发布。
Seres Therapeutics 公司则使用了另一种方法:其开发的以 FMT 为基础的治疗方法是基于一种从粪便中分离出来的产孢子细菌。
目前,针对复发性 CDI 的 Ser-109 的 III 期临床实验正在开展中;治疗溃疡性结肠炎的 Ser-287 处于 II 期临床实验阶段;SER-401 则正在进行一项 1b 临床试验,该试验旨在增强免疫检查点抑制剂 nivolumab 的疗效。
总部设在法国的 MaaT Pharma 制药公司正在开发 MaaT013,目前该候选药物正在进行治疗移植物抗宿主病的 II 期临床试验。
目前,微生物组领域急需针对基于 FMT 疗法的监管批准,来证实“微生物作为药物”可以作为一种治疗方法。然而,即使经过了批准,考虑到基于 FMT 疗法的供体来源的特性,因此,仍然需要严格的安全监测11。
另外,如何获得足够的来源于健康供体的粪便,以确保能够稳定提供药物产品也面临着挑战。

多菌株活体疗法
“微生物作为药物”的第二类是多菌株活体疗法。该疗法所使用的细菌菌株是从生物学样品中分离出来的,比如唾液和粪便,并且一经分离,细菌菌株将在克隆细胞库中传代,因此这一疗法无需供体。
多菌株活体疗法中的候选菌株可能是因为具有某种生物学功能才被挑选,比如,能够产生特定的代谢物、诱导需要的免疫应答和/或抑制某些病原体。
虽然多菌株活体疗法不会受到供体可用性的限制,但是这一类产品的制造也并不容易,因为多菌株活体疗法中的细菌菌株通常是厌氧生物,因此需要在 GMP 条件下对生产过程进行优化。
目前有几家公司正在研发多菌株活体疗法,最有优势的候选产品正处于 II 期临床试验中。
其中,拥有最多资源的是 Vedanta Biosciences 公司,现在有 4 种多菌株活体疗法产品正在进行临床试验。
VE303,含有 8 种细菌菌株,正处于治疗 CDI 的 II 期临床试验阶段;VE416处于针对食品过敏的 1b/2 阶段的临床试验阶段;VE800(包括可以诱导 CD8+ T 细胞的菌株),目前正在与免疫检查点抑制剂 nivolumab 联用,以测试治疗某些癌症的效果。此外,还有一款针对 IBD 的 VE202 候选药物。
其他具有此类 LBPs 产品的公司还有 Siolta Therapeutics 和 Assembly Biosciences 公司。前者的 STMC-103 产品正在进行治疗过敏性哮喘和其他过敏症状的 1b 临床试验,后者的 ABI-M201 则在进行治疗溃疡性肠炎的 1b 临床试验。
单菌株疗法:共生菌
单菌株疗法是“微生物作为药物”中相对不复杂的一个类别。就像多菌株疗法一样,单菌株疗法也无需供体。另外,由于只需要生产一种菌株,因此,与多菌株疗法相比,其 GMP 条件的生产过程要更简单一些。
Evelo Biosciences 公司已经启动了两个单菌株产品的 1b 临床试验,用于治疗皮肤炎症。此外,Evelo 旗下的单菌株产品还在与免疫检查点抑制剂 pembrolizumab 联用以改善对癌症的治疗效果,目前正在进行 1/2 期临床试验。
总部位于英国的 4D Pharma 公司正在评估多个单菌株治疗方法在胃肠道疾病治疗中的效果,包括正在进行的一项针对肠易激综合征的II期临床试验。
此外,4D Pharma 还在研发治疗肿瘤的 MRx0518 产品,包括单独治疗和与免疫检查点抑制剂 pembrolizumab 联合治疗。
Caelus Health,一家位于荷兰的公司,正在评估细菌 Eubacterium halli 治疗代谢性疾病——2 型糖尿病的效果。
Osel 公司则有两款单菌株治疗产品正在进行临床试验,一种是针对阴道健康的乳杆菌(Lactobacillus)菌株,另一种是针对抗生素相关性腹泻和 IBD 的丁酸梭菌(Clostridium butyricum)菌株。
单菌株疗法:工程细菌菌株
工程细菌菌株是一个特别的单菌株疗法类别。
工程菌株,一般使用非致病的大肠杆菌 E. coli,通常将其作为载体,在肠道中发挥特定的功能。
Synlogic 公司在这一领域中相对领先。其候选产品 SYNB1618 是一种大肠杆菌工程菌株,含有苯丙氨酸降解酶基因,目前正在进行治疗苯丙酮尿症的临床试验。
由于工程菌与自然菌株存在差异,考虑到后续的专利分析,所以在本文中,我们将它们单独分类,归于一个不同于其他所有的“微生物为药物”的类别中。
微生物组产品的专利
为研发的治疗产品申请专利保护是很有必要的。治疗方法的专利保护可以有多种形式,包括成分、治疗方法和配方的权利要求。在这些形式中,成分专利保护是金标准,因为无论治疗过程中使用了什么方法或配方,这一专利都可以提供保护。
为了获得专利保护,治疗产品必须有效、新颖、非显而易见性(no-obvious)且需要有完善的描述。这些申请要求并非治疗产品所独有,任何领域的专利申请都要满足这些要求。
虽然略有差异,但是包括中国、欧洲、日本和美国在内的国家对专利资格的要求基本是一致的。
根据美国法律,这些要求在美国法典(United States Code, USC)中被编入第 35 部分 USC§101(实用性)、§102(新颖性)、§103(非显而易见性)和 §112(书面说明和支持)中12。
在美国,效用要求规定了专利资格的界限。在第 35 部分 USC § 101 申明中规定,“任何人发明或发现任何新的和有用的工艺、机器、制造物或物质成分,或任何新的和有用的改进,都可能获得专利,但需要符合本篇的条件和要求。”
所以,从这一条例中可以获知,有 4 种符合专利资格条件的类型:一种工艺、一种机器、一种制造物品和一种物质组成。在这4种符合专利资格的类型之外,又设定了不符合专利资格的三种类型:抽象的想法、自然法则和自然现象。
因此,对于微生物组疗法来说,就提出了一个问题:微生物组疗法是否会由于被判定为自然现象而失去专利资格?
美国最高法院的一些案件已经确定了天然产品专利资格的范围:特别是 Funk Brothers13(仅仅因为这些细菌具有抑制性,无法对这一细菌的成分申请专利)和 Chakrabarty14(存在外源质粒的细菌菌株可以申请专利)。
然而,在 2012 年和 2013 年,美国最高法院在 Mayo15(优化药物在血液中含量的方法不具有专利资格)和 Myriad16(分离的生物分子不具有专利资格)案件中缩小了天然产品申请专利资格的范围。
在医疗领域,对 Mayo 和 Myriad 的判决在为天然产品申请专利保护方面的影响深远。
Mayo 和 Myriad 的案例发生之前,在对天然产品进行专利申明时,专利资格并不是一个问题。一般地,在专利申明中陈述“分离”或“纯化”就可以将所要保护的产品与自然界中发现的物质区分开来,因为在自然环境中,物质既不是分离的,也不是纯化的。
然而,在 Mayo 和 Myriad 的判决之后,美国专利商标局(US Patent and Trademark Office, USPTO)发布了 §101 审查规定,这对天然产品成分申明的专利申请造成了巨大阻碍。
虽然使用天然产品的方法仍然可以获得保护,但想要获得对涉及天然产品的成分专利保护却变得几乎不可能。
2014 年,USPTO 发布了《专利主题资格暂行指南》(其他示例在随后的指南出版物中增加),这是相关专利申请重获可能的一个信号17。
USPTO 为天然产品的专利资格设立了一个 2 步测试。
测试的第一部分是评估专利申明是否与天然产品有关。如果认为一项申明是对天然产物的描述,那么专利申请中必须证明该专利所涉及的产品“远不止(significantly more)”天然产物。
指南中包含了一些可以构成“significantly more”的具体例子,其中有两个例子与微生物相关:第一个例子中描述了转入了外源质粒的细菌菌株可以获得专利资格,以这种方式获得专利资格的是 Chakrabarty14;第二个例子是多菌株疗法,这种菌株组合在自然条件下不存在,且在联合使用时可以产生新的生物功能。
然而,即使有了新的程序,专利审查员也经常驳回天然产品成分的专利声明。
只有在 USPTO 颁发“101 specialists”作为附加材料后,专利申诉才得以恢复。
目前被 §101 驳回的相关专利申请正在围绕“significantly more”展开。虽然随着时间的推移,构成“significantly more”的标准正在逐渐放宽,但这仍然是获得天然产品成分申明专利的一个重大障碍。
Box1 美国微生物组专利起诉的经验教训
最近的一个例子说明了 USPTO 目前的标准。这一例子是美国专利号 10456431,该专利名为 “治疗艰难梭菌感染的治疗”,属于 Vedanta Biosciences。专利申明 1 中记载:
1.一种药物组合物,包括纯化细菌混合物,其中所涉及的细菌菌株的16S rDNA序列与下列序列的相似性至少为 97%,SEQ ID NO:10、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:16、SEQ ID NO:17、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21;一种或多种肠道聚合物(enteric polymers);所述药物组合物中每个细菌含有 1x107到 1x1010菌落形成单位(CFU);并且以为胶囊形式提供。
本专利诉讼中的主要问题是与满足 §101 规定的专利资格相关。此外,专利审查员最初认为,肠道聚合物并没有在结构或功能上对自然出现的细菌菌株做出改变,审查员认为肠道聚合物“仅仅‘保护’了细菌菌株”,但是实际上没有对细菌菌株本身做出任何改变。
(US 10456431 的文件记录可在 USPTO 的公共配对门户网站上找到,https://portal.uspto.gov/pair/PublicPair)
然而,USPTO 后续通过了此专利的申请,因为 USPTO 认为胶囊形式的细菌混合物与其他元素(包括肠道聚合物)的结合是合理的。“将司法例外运用到实际应用中,如本案例中的组合产生了可帮助药物运送至受试者消化道内的特定位置的功能特性。”
也就是说,在这一案例中,USPTO 将肠道聚合物和胶囊制剂与天然产物区别开来并视为一种合规的成分申明,并不是由于细菌在自然界中不以这种形式出现,而是因为申明中描述了对治疗有影响。这潜在地代表了 USPTO 观点的重大转变。
为微生物组疗法申请专利
“微生物为药物”的三种类型在申请专利保护时都面临着挑战。
基于 FMT 的疗法有三个主要障碍:(1)证明 FMT 疗法远胜于天然产品;(2)证明其新颖性和非显而易见性;(3)对 FMT 疗法详细的描述。
基于 FMT 的治疗方法可以说是天然粪便的改造版,这些改造包括过滤、冻干、包封或上述改造的组合。
由于 FMT 的成分还没有被完全鉴定清楚,因此要表明这些产品比天然产品更具有优势是有挑战的。
其次,FMT 疗法具有较长的历史,这意味着存在现有技术,因此在证明其新颖性和非显而易见性时会比其他微生物组疗法面临更多潜在挑战。
最后,由于 FMT 的成分无法被完全鉴定,因此其成分申明通常依据工艺生产的形式,也就是通过获得产品的方法而不是通过其特性来描述产品成分。
由于成分专利申明方面的挑战,因此,涉及 FMT 的微生物组疗法大多数都是采用方法专利申明。
与任何其他专利申明一样,微生物疗法中的第二类,多菌株活体疗法也必须满足专利资格、新颖性、非显而易见性和描述要求才能获得专利。为了证明专利资格符合 §101 的规定,多菌株活体疗法的专利申请或许可以参考指南17中提供的“联合使用的细菌可以产生新的功能”例子。
然而,USPTO 审查员并没有特别接受这些论点,即使细菌组合物的功能已经在专利申明中详细介绍。
最成功的申明策略是在专利申请中明确叙述“significantly more”的部分(见 box 1)。
至于新颖性和非显而易见性的要求,对于多菌株活体疗法而言,如果细菌菌株联合组成了之前没有描述过的组合,那么通常能够满足这些要求。
描述上可以采用给予菌群中特定细菌的名称(例如,Clostridium ramosum)或通过菌株的特异性识别核酸序列(例如,美国专利 10456431 申明 1 的描述:“包含与序列 SEQ ID NO X 有至少 97%同源性的 16S rDNA 的细菌菌株”)。
不过,使用名字来定义细菌菌株具有潜在问题,因为细菌可能会被重新归类或重新命名,这会使定义专利申明的边界变得更加复杂。而使用序列来描述细菌菌株在精确性上具有优势:在专利申明中,有特定的序列的菌株提供了明确的判断标准。
单菌株细菌治疗分为两大类:共生菌或者工程菌株。
通过定义可以把工程菌株同自然界发现的产品区分开,不过这些专利申明需要克服任何与天然产品相关的,用于驳回专利资格的条例。
而包含共生菌株的单菌株治疗方法则会受 § 101 专利资格障碍的限制。由于只有一种细菌菌株,因此不能提出细菌菌株具有某种协同作用的说法,而且通常必须在专利申明中明确写出可以克服驳回专利资格的“significantly more”的部分。
此外,为了表明专利的新颖性,菌株本身必须是新颖的。因此,大部分共生单菌株微生物组疗法相关的专利申明也都是方法申明。

Box2 微生物专利的挑战:来自欧洲的经验
专利异议被广泛用于攻击欧洲专利局(European Patent Ofce, EPO)授予的专利。
2019 年针对欧洲专利号为(EP)2575835 的反对诉讼受到密切关注,该专利由东京大学拥有,独家授权给 Vedanta Biosciences 公司,该案例展现了微生物治疗专利申请面对的激烈挑战。
这一案件的反对者有 6 位:雀巢公司、Seres Terapeutics 公司和 4 位匿名反对者。
这项专利申明中表示该成分可用于治疗感染性病、自身免疫性疾病或过敏性疾病。专利的申明 1 记载如下:
一种用于治疗或预防感染性疾病、自身免疫性疾病或过敏性疾病的组合物,所述组合物包括作为活性成分的细菌,所述细菌包括能够形成孢子的属于 IV 和 XIVa 类的梭状芽孢杆菌的组合,该组合可诱导受试者中转录因子 FoxP3 阳性调节性 T 细胞的增殖或积累。
专利受到质疑的理由如下:
A.披露的有效性[《欧洲专利公约》第 83 条;与《美国法典》第 35 部分第 §112(a)相似]
对手观点如下:
1.申明中提出的可以使用该成分治疗感染性疾病、自身免疫性疾病和过敏性疾病是不可信的;
2.在专利申明中包括的这些细菌中,难以确定哪一种细菌具有 FoxP3+ 调节 T 细胞诱导效应;
3.本专利没有充分描述如何鉴定“形成孢子”的菌株;
4.传染性疾病可以从免疫抑制性 FoxP3+ 调节 T 细胞的增加中受益是难以置信的。
B.新颖性和创造性步骤(《欧洲专利公约》第 54 和 56 条;与《美国法典》第 35 部分第 §102 和 §103)
反对者引用了超过 120 多篇现有的参考文献,包括有关 IBD 治疗的摘要,以及与 FMT 相关的文献。反对者认为 FMT 本身就包含能够形成孢子的属于IV和 XIVa 类的梭状芽孢杆菌。
在诉讼之前,专利所有人提交了适用于自身免疫性疾病主张的撤回申请。(在 2020 年 4 月 29 日,针对三种疾病的 EP 3178483、EP 3539548 和 EP 355261 获批,上述专利的申请优先级高于 EP2575835。获批的专利中包括针对治疗自身免疫疾病的专利申明。)
在三天的口头听证会上,讨论了大量的辅助申明修正案,最终 EPO 作出决议,认为以下修正申明有效(修改部分用下划线表现):
1一种通过诱导转录因子 FoxP3 阳性调节性 T 细胞的增殖或积累来治疗或预防感染性疾病或过敏性疾病的组合物,所述组合物包括作为活性成分的梭菌属的细菌,所述细菌包括能够形成孢子且属于 IV 和 XIVa 类梭状芽孢杆菌的组合,其组合可诱导受试者的转录因子 FoxP3 阳性调节性 T 细胞的增殖或积聚。
简言之,EPO 驳回或合理化了披露不足的问题,并将重点放在专利提出的新认识上,即可诱导 FoxP3+调节性 T 细胞的特定集群细菌具有治疗效果。
专家小组认为,通过调节 T 细胞诱导的机制直接和所述疾病的治疗相联系,属于 “一种新的临床情况”,临床医生可依据此调整治疗方法,比如,避免某些与 FMT 相关的问题。
在此基础上,EPO 认为,该专利区别于现有技术,原因是现有技术没有认识到或者忽视了包括所述细菌在内的组合物对调节 T 细胞诱导的重要性。
虽然每个案例都要根据其自身特点进行判决,但是考虑到这一案件反对者的数量和反对者论点的性质,因此该案件的结果鼓舞了微生物组治疗领域的专利持有者。

专利的有效性和未来的发展
在美国和其他地区已经签发了大量微生物组相关的专利。虽然在新技术开发的早期阶段,签发批量专利申明并不少见,但这些专利申明常常在签发后的程序中受到质疑。
在强制执行诉讼或专利审判和上诉委员会(Patent Trial and Appeal Board, PTAB)执行程序前,已发行的美国专利被认为是有效的。
由于微生物组治疗领域相对较新,而且很可能是因为市场上还没有批准的微生物疗法,截至 2020 年 4 月,还没有任何审判案件能够提供关于微生物组相关专利的有效性或 §101 规定的专利资格的见解。
PTAB 的诉讼程序相对较少,可能是因为其附带的潜在禁止反言(potential estoppel)条例。在 PTAB 程序中提出的任何合理的论点,都不能在之后的法庭上提出。(参考欧洲的例子,见 box 2;欧洲没有禁止反言的规定,因此通过反对程序质疑已发行的专利很常见)。
不过,最近的一次授权后审查(post-grant review, PGR)程序中,PTAB 裁定了一项微生物组领域的关键专利。被质疑的微生物组专利是美国专利号:9855302,颁发给芝加哥大学,授权给 Evelo Biosciences 公司18。
该专利的申明 1 写道:“一种治疗人类癌症的方法,对受试者使用免疫检查点抑制剂和包含双歧杆菌(Bifidobacterium)的细菌制剂。”
肠道菌群对免疫检查点抑制剂在癌症中治疗效果的影响在相关领域中引起了轰动。
2018 年,芝加哥大学获得了相关的专利。该专利 PGR 的申请者是韩国的 Genome&Company 公司,该公司正在与默克公司(Merck KGaA)和辉瑞公司(Pfizer)合作,研究其旗下的单菌株疗法与抗 PD-L1 抗体 avelumab 联合治疗的效果。
申请者质疑这一专利的有效性,理由是该专利缺乏可实施性,且与现有技术相比不具有不显而易见性。
简单来说,关于可实施性,申请者认为,专利申明有些言过其实,该专利没有明确具体的双歧杆菌菌株,也没有明确具体的检查点抑制剂药物以及具体的癌症,而是将一切混为一谈。而在专利附带的例子中,仅描述了某些双歧杆菌与一种检查点抑制剂(抗 PD-L1)对两种癌症(黑色素瘤和膀胱癌)动物模型的治疗。
申请者认为,不同种类的双歧杆菌与不同检查点抑制剂联合使用来治疗不同癌症的效果是不可预测的。
申请者还认为,此项发明是显而易见的,原因是现有的参考文献中已经描述了可以使用检查点抑制剂对结肠癌的治疗,也有文献描述口服长双歧杆菌(Bifidobacterium longum)可以抑制结肠癌。
委员会同意申请人的观点,裁定此项专利申明因缺乏证据和/或显而易见,所以无效。
虽然这对其他微生物组专利来说并不是有约束力的法律先例,但有趣的是,委员会认为,专利申明缺乏有效性是由于对检查点抑制剂解读过多,而不是由于该专利将双歧杆菌包括在内。
此项专利明确地将检查点抑制剂描述为包含抗体和核酸抑制剂,然而对抗体之外的任何抑制剂却没有描述。
相反,委员会看重的是使用双歧杆菌的例子和如何确定是否是由细菌促进了免疫检查点抑制剂的抗肿瘤活性以及如何确定双歧杆菌属是有作用的。
关于显而易见性,委员会同意将两种治疗癌症的方法结合到一起的效果是显而易见的。
虽然在美国功能性语言描述的分量要低于欧洲,但是委员会认为,虽然现有文献没有表明长双歧杆菌可以促进抗肿瘤的免疫应答,但是考虑到检查点抑制剂和细菌都曾单独用来治疗结肠癌,因此将两种方法结合来治疗结肠癌是可以接受的。
微生物组疗法领域目前正在解决许多监管、制造和专利方面的挑战。该领域的下一个重要目标是让 FDA 批准一种微生物组疗法。
在专利领域,微生物组治疗的专利资格阻碍依然存在。然而,根据最近的专利起诉案例,USPTO 愿意与专利申请者合作,来促成专利的通过。
因此,该领域的下一步是观察已签发的专利是否能经受住诉讼审查的考验,而这将为如何更好地保护微生物疗法提供进一步的见解。
参考文献:
(滑动下方文字查看)
1.Young, V. B. Br. Med. J. 356, j831 (2017).
2.Marchesi, J. R. et al. Gut 65, 330–339 (2016).
3.Brody, J. E. Unlocking the secrets of the microbiome. Te New York Times (7 November 2017).
4.Anonymous. Te human microbiome: me, myself, us. Te Economist (18 August 2012).
5.Zhang, F., Luo, W., Shi, Y., Fan, Z. & Ji, G. Am. J. Gastroenterol.107, 1755 (2012). author reply 1755–1756.
6.Borody, T. J. & Campbell, J. Expert Rev. Gastroenterol. Hepatol. 5, 653–655 (2011).
7.van Nood, E. et al. N. Engl. J. Med. 368, 407–415 (2013).
8.Atarashi, K. et al. Science 331, 337–341 (2011).
9.Tanoue, T. et al. Nature 565, 600–605 (2019).
10.Almeida, A. et al. Nature 568, 499–504 (2019).
11.DeFilipp, Z. et al. N. Engl. J. Med. 381, 2043–2050 (2019).
12.35 USC § 112(a).
13.Funk Brothers Seed Co. v. Kalo Inoculant Co., 333 US 127 (1948).
14.Diamond v. Chakrabarty, 447 US 303 (1980).
15.Mayo Collaborative Services v. Prometheus Laboratories, Inc., 566 US 66 (2012).
16.Association for Molecular Pathology v. Myriad Genetics, Inc., 569 US 576 (2013).
17.USPTO. Interim Guidance on Patent Subject Matter Eligibility, 79 FR 74618 (16 December 2014).
18.PTAB Case Number PGR2019-00002 (2019).
原文链接:https://www.nature.com/articles/s41587-020-0579-z
作者|Mark J. FitzGerald、Erik J. Spek
编译|gemiu
审校|617


