
编者按:
母乳含有丰富的营养,对于宝宝的生长发育至关重要。近年来的研究发现,母乳中存在的某些微生物代谢物或许也发挥着重要的作用。
今天,我们特别编译发表在 Trends in Microbiology 杂志上题为 Microbial metabolites:the next frontier in human milk 的文章。希望本文能够为相关的产业人士和诸位读者带来一些启发和帮助。
越来越多的研究正在将微生物代谢产物用于治疗多种微生物组相关疾病1。但是,目前为止,表征母乳中这些物质及其对于婴儿健康潜在影响的研究仍然有限。
母乳中存在的微生物代谢产物可能对于母乳喂养的婴儿具有免疫或代谢调节作用,因此这是一个重要的研究领域。尽管目前这一领域的研究很少,但是越来越多的证据表明,微生物代谢产物在母乳中是存在的。另一些证据则表明,这些代谢产物可能会对母乳喂养的婴儿生长发育过程产生影响。
本文我们重点描述了 4 类可能会对婴儿健康产生影响的关键微生物代谢产物。
由于这些物质都是膳食纤维、氨基酸等膳食组分经由微生物代谢产生的,所以我们猜测它们在母乳中的含量受到母体膳食影响。基于此,微生物组相关的代谢产物可能是哺乳期的一个重要靶标,可以帮助我们改善婴儿的健康。
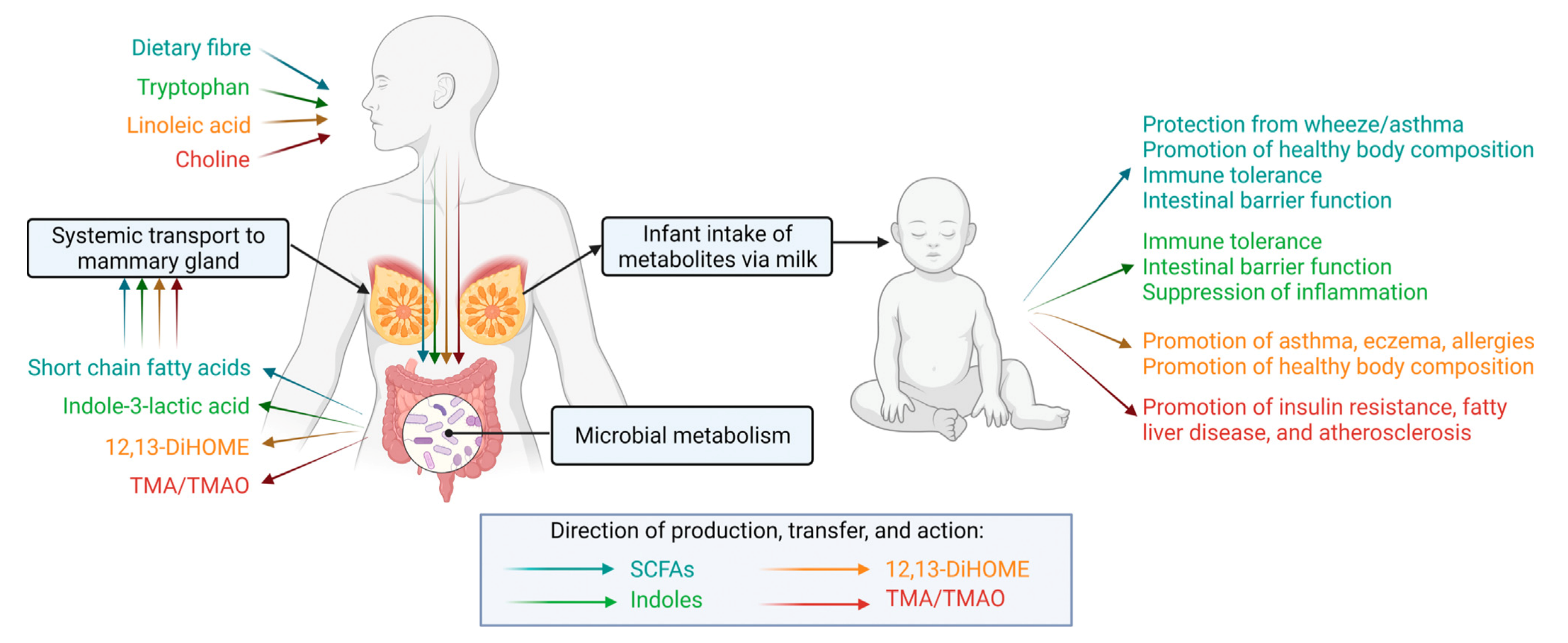
① 短链脂肪酸(SCFAs)
多种肠道细菌都可以代谢膳食纤维产生 SCFAs。因此,肠道微生物组产生的 SCFAs 的组分和含量,受到摄入纤维的种类和数量以及肠道微生物组组成的共同影响。
SCFAs 可以作为宿主的能量底物或信号分子发挥作用。通过与 G 蛋白偶联受体的互作以及对组蛋白脱乙酰酶的抑制作用,SCFAs 可以引发机体的一系列反应。SCFAs 能够促进调节性 T 细胞(Tregs)和免疫耐受,也能够抑制炎症反应,并通过维持肠道屏障完整性,来调节生命早期阶段的免疫系统功能2。SCFAs 还能够通过抑制食欲、调节脂质代谢(如增加脂肪氧化,减少脂肪合成和储存)以及调节血糖稳态,来影响宿主代谢2。
因此,SCFAs 是预防或调节如过敏性疾病、肥胖等非传染性疾病(NCDs)的关键性物质。事实上,目前有一些临床试验正在评估 SCFAs 治疗多种 NCDs 的潜力1。
许多研究都表明,母乳中 SCFAs 的水平个体差异很大3。母乳中的 SCFAs 可能是由肠道细菌产生并通过血液循环运送到乳腺的。它们也可能是由母乳中的细菌产生的,但目前尚无试验依据支持这种可能性。
越来越多的证据表明,生命早期暴露于母体的 SCFAs,可以促进免疫耐受。在啮齿动物中,母体孕期和哺乳期采取高膳食纤维/益生元饮食,可以降低后代发生过敏性呼吸道疾病的概率4-5。给母体直接补充含有乙酸盐的膳食补充剂,也获得了相同的实验结果4,这表明了这种 SCFA 对于免疫健康发育的核心作用。
在人体中,类似地,母亲孕期时血浆中乙酸盐的高含量与婴儿出生后第一年中哮喘发生的风险降低有关4。
母乳中的 SCFAs 还可能会影响婴幼儿的身体发育。乳中的 SCFAs 与婴儿一岁内的体重、体重指数(BMI)以及皮褶厚度呈现负相关6。这一发现并不让人意外,因为 SCFAs 与抑制食欲、血糖稳态和脂肪氧化有关7。因此,母乳中存在的 SCFAs 可能解释了母乳喂养带来的预防肥胖的作用。
尽管 SCFAs 与膳食之间存在联系,但是尚无研究评估母体饮食对于母乳中 SCFAs 的组成的影响。不过,不同地区的母亲母乳中 SCFAs 的组成有着很大的差异,这提示了膳食所带来的影响。特别是,相比于身处采纳典型西方饮食的国家(如美国),身处在常食用发酵食物的国家(如日本和挪威)的母亲,其母乳中的 SCFAs 水平会更高3。
考虑到 SCFAs 对于生命早期健康发育的重要性,上述这一发现应当通过饮食干预试验来进行更深入的研究探索,如控制母亲膳食中的纤维摄入量,然后评估母乳中 SCFA 水平的变化。此外,也需要有更多研究对母乳中 SCFAs 水平与母体肠道微生物组产生 SCFA 能力的相关性进行分析。

② 吲哚
吲哚是肠道细菌代谢色氨酸的产物。这类物质可以通过与芳香烃受体(AhR)和胆汁酸受体(FXR)的互作,影响宿主生理机能8。吲哚对先天免疫、抑制炎症、清除自由基和维持肠道免疫屏障完整性很重要8。
对于完全进行母乳喂养的婴儿来说,母乳是色氨酸的唯一来源,但是,目前尚未从母乳中分离出吲哚类物质。不过,在母乳和婴儿肠道中存在的典型细菌种类都已被证明能够在体外产生吲哚-3-乳酸(ILA)9-10。
ILA 在人工培养的婴儿肠道细胞和成人肠道细胞中都表现出了抗炎症作用9-10。当使用母乳寡糖时,婴儿双歧杆菌会产生更多的 ILA11,而母乳喂养的婴儿相比于配方奶粉喂养的婴儿,粪便和尿液中的 ILA 含量显著更高12。
总的而言,这些证据表明,ILA 可能是婴儿肠道或母乳中双歧杆菌中产生的重要的吲哚类物质。未来的研究应当研究母乳中的吲哚类物质,特别是 ILA,以确定其是否存在,并研究它们与母亲和婴儿健康之间的关联。
③ 12,13-DiHOME
12,13-二羟基-9Z-十八碳烯酸(12,13-DiHOME)是亚油酸代谢的终产物,是一种与哮喘和过敏发生密切相关的脂氧化物。在患有继发性过敏、湿疹或哮喘的一周龄婴儿的粪便中,这种物质显著增加13-14。
离体实验表明,12,13-DiHOME 能够在树突状细胞中调节 PPAR-γ 介导的基因表达,以剂量依赖性的方式减少调节性 T 细胞的比例13,并减少树突状细胞中抗炎白细胞介素-10(IL-10)的分泌14。经 12,13-DiHOME 预处理的小鼠在暴露于蟑螂抗原后,炎症反应增加,肺部的调节性 T 细胞水平下降,过敏反应加剧14。
除了会对免疫系统有所影响之外,母乳中的 12,13-DiHOME 也与婴儿的机体组成相关。Wolfs 等最近报道发现,产后第一个月乳中 12,13-DiHOME 与婴儿 0-6 个月皮下脂肪和 BMI 的增加呈现负相关15。

④ 甲胺
三甲胺(TMA)是肠道细菌代谢胆碱的产物。TMA 会在肝脏中被转化为氧化三甲胺(TMAO),然而人体肠道中的细菌能够将 TMAO 再还原为 TMA。TMA 和 TMAO 与一系列代谢疾病和心血管疾病具有相关性,包括胰岛素抵抗、脂肪性肝病和动脉粥样硬化1。
尽管母乳中存在较高浓度的游离胆碱,但是目前仅有一项研究在母乳中发现了 TMA16。该研究在初乳和母乳中检测出了低含量的 TMA(<5ppm)。牛奶中也同样发现了 TMA 的存在17,这表明了哺乳动物肠道中产生的代谢产物很可能会被转运到乳腺中。
未来还需要更深入的研究对母乳中的 TMA 进行表征,特别是对于其与母体饮食和婴儿长期心血管及代谢状况之间的关系。母体膳食中的胆碱摄入量很可能会影响母乳中 TMA/TMAO 的水平。因此,研究素食饮食和杂食饮食的母亲母乳中的 TMA/TAMO 可能会很有意义。
近年来,非传染性疾病的发生率不断增加,这使得很多人开始探索生命早期的微生物组是否是造成这些疾病的潜在原因。
然而,现在的研究应当不再局限于细菌,而应从一个更为整体、功能化的视角来看带生命早期的人类微生物组,这其中就包括了细菌代谢的产物。这将会为生命早期微生物组的动态变化以及发育过程带来更为深入的理解。
重要的是,对于进行母乳喂养的母婴而言,我们需要表征母亲微生物、母乳中细菌代谢产物与婴儿生长发育之间的关系。
要确定潜在的有效代谢产物,评估膳食干预对于母乳中这些组分的调节作用,并表征这些代谢产物对于婴儿生长发育的作用,这一领域仍然需要更深入的研究。
未来的研究可以围绕以下问题开展:
• 母体肠道微生物组产生的哪些代谢产物会被运送到乳腺?
• 乳腺中是否会产生一些细菌代谢产物?
• 母乳中来自母体的细菌代谢产物在经过婴儿消化道后,还有多少可以被肠道吸收?
• 母乳中细菌代谢产物对于婴儿的健康及免疫/代谢发育的影响程度如何?
• 可以通过膳食干预或靶向补充来调节母乳中膳食来源的细菌代谢产物的水平吗?
• 目前,许多临床试验正在将天然存在的细菌代谢产物作为“后生元”用于治疗微生物组相关的非传染性疾病。那么这种方法是否也能改善高疾病风险婴儿的免疫和代谢发育,从而减少此类疾病的发生率?
研究母乳中微生物组相关的代谢产物,未来仍然需要更多的靶向和非靶向代谢研究。本文中所举的例子凸显了细菌代谢产物对于关键发育窗口(即哺乳期)的免疫和代谢功能发育的潜在作用。母亲的细菌代谢产物也意味着在哺乳期进行靶向的“后生元”干预具有一定前景。或许,可以通过调节母亲的饮食或是直接补充关键代谢产物来实现改善婴儿健康这一目标。
参考文献:
1. Descamps, H.C. et al. (2019) The path toward using microbial metabolites as therapies. EBioMedicine 44, 747–754
2. Tan, J. et al. (2014) The role of short-chain fatty acids in health and disease. Adv. Immunol. 121, 91–119
3. Stinson, L.F. et al. (2020) Human milk from atopic mothers has lower levels of short chain fatty acids. Front. Immunol. 11, 1427
4. Thorburn, A.N. et al. (2015) Evidence that asthma is a developmental origin disease influenced by maternal diet and bacterial metabolites. Nat. Commun. 6, 7320
5. Hogenkamp, A. et al. (2015) Supplementation of mice with specific nondigestible oligosaccharides during pregnancy or lactation leads to diminished sensitization and allergy in the female offspring. J. Nutr. 145, 996–1002
6. Prentice, P.M. et al. (2019) Human milk short-chain fatty acid composition is associated with adiposity outcomes in infants. J. Nutr. 149, 716–722
7. Kumari, M. and Kozyrskyj, A.L. (2017) Gut microbial metabolism defines host metabolism: an emerging perspective in obesity and allergic inflammation. Obes. Rev. 18, 18–31
8. Roager, H.M. and Licht, T.R. (2018) Microbial tryptophan catabolites in health and disease. Nat. Commun. 9, 3294
9. Wickramasinghe, S. et al. (2015) Bifidobacteria grown on human milk oligosaccharides downregulate the expression of inflammation-related genes in Caco-2 cells. BMC Microbiol. 15, 172
10. Meng, D. et al. (2020) Indole-3-lactic acid, a metabolite of tryptophan, secreted by Bifidobacterium longum subspecies infantis is anti-inflammatory in the immature intestine. Pediatr. Res. 88, 209–217
11. Ehrlich, A.M. et al. (2018) Bifidobacterium grown on human milk oligosaccharides produce tryptophan metabolite indole-3-lactic acid that significantly decreases inflammation in intestinal cells in vitro. FASEB J. 32, lb359
12. Laursen, M.F. et al. (2020) Breastmilk-promoted bifidobacteria produce aromatic lactic acids in the infant gut. bioRxiv 2020.01.22.914994
13. Fujimura, K.E. et al. (2016) Neonatal gut microbiota associates with childhood multisensitized atopy and T cell differentiation. Nat. Med. 22, 1187–1191
14. Levan, S.R. et al. (2019) Elevated faecal 12,13-diHOME concentration in neonates at high risk for asthma is produced by gut bacteria and impedes immune tolerance. Nat. Microbiol. 4, 1851–1861
15. Wolfs, D. et al. (2021) Brown fat-activating lipokine 12,13- diHOME in human milk is associated with infant adiposity. J. Clin. Endocrinol. Metab. 106, e943–e956
16. Lichtenberger, L.M. et al. (1991) Evidence for a role of volatile amines in the development of neonatal hypergastrinemia. J. Pediatr. Gastroenterol. Nutr. 13, 342–346
17. Lunden, A. et al. (2002) High trimethylamine concentration in milk from cows on standard diets is expressed as fishy off-flavour. J. Dairy Res. 69, 383–390
原文链接:
Stinson L F, Geddes D T. Microbial metabolites: the next frontier in human milk[J]. Trends in Microbiology, 2022. DOI: 10.1016/j.tim.2022.02.007
作者|Lisa F. Stinson和Donna T. Geddes
编译|C。
审校|617
编辑|咲


