编者按:
今天我们来关注一下在食物链中与人类健康息息相关的猪的肠道菌群。
本文是美国堪萨斯州立大学兽医学院助理教授 Megan C. Niederwerder 写的一篇文章,他认为,肠道菌群调节或是预防猪的致病性感染的重要替代策略,并介绍了他们团队的相关研究成果,主要探讨如何通过肠道菌群调节来解决影响全球养猪业的呼吸系统感染。
作者 | Megan C. Niederwerder
翻译 | 赵婧
审校 | Susan
仔猪的初始肠道菌群会在出生后的几周内即完成初步定植。影响菌群定植的因素包括:出生环境、母猪阴道、皮肤和粪便菌群;初乳及哺乳期乳汁的成分;由乳汁向固体饲料的过渡;居住环境和畜舍的过滤系统;致病性的感染;抗生素注射及饲料中抗生素的添加;生产或运输过程中的应激。通常,这些因素可能会终身影响猪的菌群组成(Niederwerder,2017)。

肠道菌群和宿主健康或疾病之间的关系是极其复杂的。虽然影响和互作机制尚未阐明,但越来越多的证据支持肠道菌群的多样性和特定组成特征在致病性感染的转归中起到了有益作用。
替代策略
过去,人们通常认为猪的肠道菌群对致病性感染的影响主要集中在腹泻相关的肠道疾病上,这是由于肠道有益菌和致病菌之间看似固有的相互作用。
例如,那些对产肠毒素大肠杆菌敏感的猪与不敏感的猪相比,其肠道菌群多样性比较低(Masuri 等人,2013);同样,在感染猪流行性腹泻病毒后出现腹泻的母猪与感染后仍保持健康的母猪相比,肠道内的细菌种类总体减少(Song 等人,2017)。
最近,人们逐渐认识到,肠道菌群对致病性感染的影响已经扩大到几乎所有身体系统的病原体,包括那些引起呼吸道感染的病原体(Niederwerder,2017)。呼吸系统感染是生长猪发病和死亡的主要原因,而调节肠道菌群已成为控制和预防这些感染的一种替代策略。
“肠-肺轴”是用来描述肠道菌群通过组分和代谢产物与呼吸道之间建立的联系。在肠-肺轴的作用下,肠道菌群的变化有可能对致病性呼吸道感染的转归或肺炎的发生有着重要影响。
一些已发表的研究表明,在人类疾病的小鼠模型中,菌群多样性和组成特征与感染病毒、细菌甚至真菌呼吸道病原体后的转归之间存在关联(Niederwerder,2017)。
例如,肠道菌群多样性增加与肺炎链球菌呼吸道感染后死亡率降低、肺部病变减少和肺泡巨噬细胞吞噬功能增强有关(Schuijt 等人,2016)。
类似地,在猪体内,肠道菌群多样性的增加和猪肺炎支原体感染的临床症状减少以及肺部损伤的减少有关(Schachtschneider 等人,2013)。此外,感染流感病毒和呼吸道合胞病毒等呼吸道病毒后的转归,也与特定的肠道菌群特征相关(Antunes 等人,2019;Rosshart 等人,2017)。
两种重要病原体的控制
影响全球养猪业的两种重要病原体分别是:猪繁殖与呼吸障碍综合征(PRRS,俗称蓝耳病)病毒(PRRSV)和猪圆环病毒 2 型(PCV2)。在全球范围内,这两种病原体的混合感染很常见,会引起生长猪的呼吸道疾病、影响猪的增重,最终导致猪肉减产。
这两种病毒都会调控免疫系统,导致淋巴细胞和巨噬细胞的免疫病理损伤。由此产生的免疫抑制增加了原发性和继发性细菌和病毒感染的风险,随后增加了抗菌药物治疗的需求。
自 30 多年前 PRRSV 第一次出现以来,据估计,PRRSV 给全球养猪业造成的经济损失至少达到 100 亿美元。最近的统计分析显示,仅在美国,每年 PRRS 造成的损失大约 6 亿 6400 万美元(Holtkamp 等人,2013)。经济损失主要来源于母猪和生长猪产量下降,再加上治疗和疫苗接种费用的增加。
尽管目前以 PRRSV 改良的活病毒疫苗被广泛应用于减少 PPRS 相关的损失,但人们逐渐发现,这种疫苗并不足以控制和根除疾病(Vu 等人,2017)。为了在养猪场中长期消灭 PRRSV,人们设计了各种方案,然而 PRRSV 往往又卷土重来。
找到控制 PRRS 的可行性策略已迫在眉睫。通过调节肠道菌群来改善增重,降低与 PRRS 相关的呼吸系统感染的发病率和死亡率,或许是一种有效策略。
考虑到肠道菌群对呼吸道病原体的潜在影响,我们将工作聚焦于 PRRSV/PCV2 共感染的仔猪模型,确定仔猪肠道菌群与疾病转归之间的关系。初步研究表明,断奶仔猪感染 PRRSV 和 PCV2 后 70 天的临床转归与肠道菌群的特征有关(Niederwerder 等人,2016)。
具体来说,我们观察到感染 PRRSV 和 PCV2 后临床症状少、体重增加不受影响的仔猪,其肠道菌群多样性高,并且肠道内存在非致病性大肠杆菌。
在完成这项初步工作之后,我们的第二个目标是确定感染前肠道菌群的特征是否与仔猪 PRRSV 和 PCV2 共感染后的转归相关(Ober 等人,2017)。结果表明,生长率高、病毒复制少和肺炎损伤较轻的猪,其感染前的肠道菌群有明显特征,包括菌群多样性高、甲烷杆菌相对较少、瘤胃球菌和链球菌相对较多。这些菌群特征或可用于预测仔猪感染后的转归。
菌群调节
在以上初步工作中,我们建立了仔猪肠道菌群特征与 PRRSV 和 PCV2 共感染后转归之间的关系,我们的第三个目标是研究菌群调节是否可以作为一个潜在的手段,来改善保育猪呼吸道疾病的转归。
我们是通过粪菌移植(FMT)来调节肠道菌群的。为了制备 FMT 移植物,通常将供体的粪便与无菌生理盐水混合成均匀的混合物,过滤去除大便颗粒,并在移植前进行处理以浓缩和保护微生物(Hamilton 等人,2012)。
FMT 移植物不仅包括活菌和死菌,还包含了微小的饲料颗粒物、小肠和大肠的细胞以及菌群代谢产物(Bojanova 和 Bordenstein,2016)。对于大多数疾病而言,FMT 的有效机制还不清楚。然而,FMT 的益处被认为是源自有益菌的增加、正常菌群的恢复、菌群多样性的增加以及粘膜和系统免疫的刺激(niederwerder,2018)。
在人类中,FMT 最常用于治疗复发性艰难梭菌感染(Gough 等人,2011)。然而,越来越热的 FMT 最近被认为是一种可用于治疗人类一系列其它疾病的潜在疗法,如肠易激综合征、多发性硬化症、自闭症、慢性乙肝、耐药病原体定植、代谢综合征和胰岛素抵抗等(Bakker 和 Nieuwdorp,2017;Cohen 和 Maharshak,2017)。
在动物中,FMT 也被用作治疗多种疾病,包括犬细小病毒感染、牛外科手术后留下的皱胃并发症、猫溃疡性结肠炎、绵羊的瘤胃酸中毒和无张力和马急性结肠炎(Furmanski 和 Mor,2017;Jasmin等人,2011;Mullen 等人,2018;Pereira 等人,2018;Rager 等人,2004)。
在动物中,除了治疗潜力外,FMT 的预防以及免疫原性应用也得到了探索。例如,FMT 可以作一种潜在手段,提高家禽和猪饲料利用率(Niederwerder,2018年);FMT用于增加针对猪流行性腹泻病毒(PEDV)母猪和后备母猪的抗体产生(Clement 等人,2016 年)。
用FMT应对PRRSV、PCV2
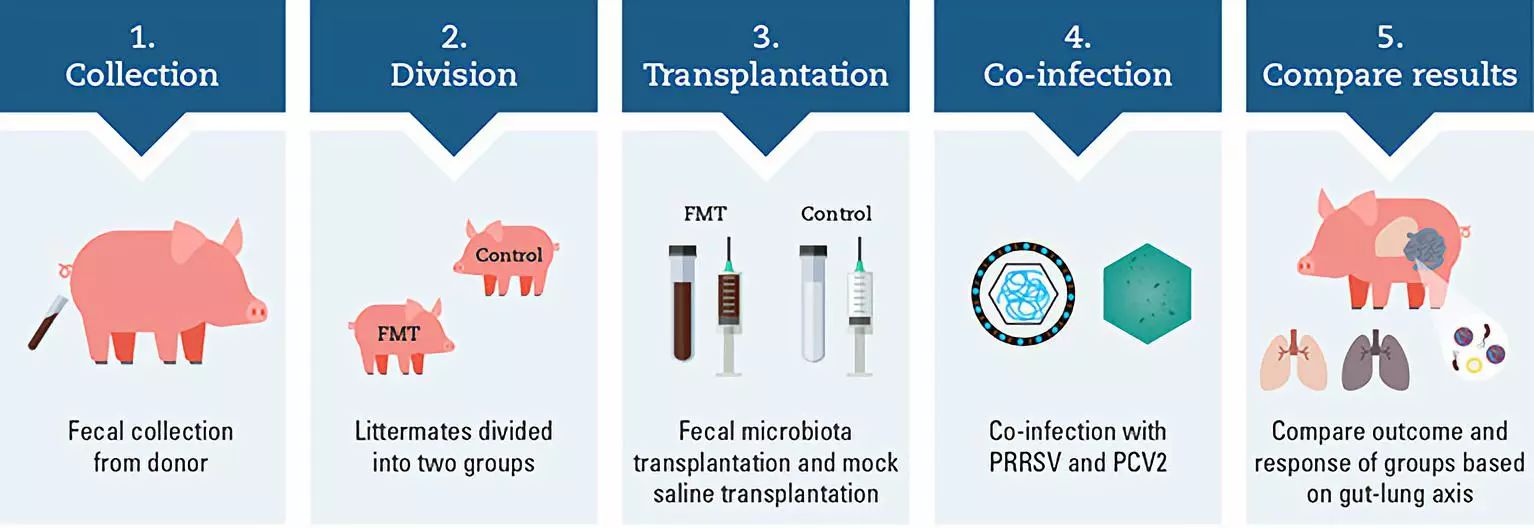
本实验旨在探讨粪菌移植对保育猪 PRRSV 和 PCV2 共感染后的转归的影响。
我们在堪萨斯州立大学实验室的工作中,研究了通过 FMT 来调节猪的肠道菌群,以预防和控制 PCV 相关疾病,并减轻 PRRSV 和 PCV2 共感染的影响(Niederwerder 等人,2018),上面的图解概述了整个实验设计。
具体地说,我们选择了两只具有高健康、高生产力特征的母猪作为供体,其具体特征包括:胎次多,窝产仔数大,产仔存活率稿,断奶前死亡率低(大多数死亡与挤压有关),无胎儿木乃伊化,提供粪便前 15 个月内未接受抗菌治疗。
我们对供体的粪便进行筛选,确认其肠道寄生虫呈阴性,然后将粪便与无菌生理盐水混合,过滤并离心以浓缩移植物中的微生物,并储存在 10%甘油中。
我们将断奶期的 10 对阉割的同胞小公猪随机分为 FMT 组和对照组,并按初始体重进行平衡。在共感染前,给 FMT 组的仔猪以每天 5 毫升的剂量连续 7 天移植上述的移植物,给对照组的仔猪以每天 5 毫升的剂量连续 7 天移植无菌生理盐水和甘油模拟的对照移植物。然后让所有的仔猪共感染 PRRSV 和 PCV2,并在感染后 42 天随访。
将 FMT 组仔猪与对照组仔猪的临床、病毒学和免疫学结果进行比较发现,FMT 组的发病率和死亡率降低,PRRSV 和 PCV2 的复制减少,增重更整齐,抗体生成增加,免疫反应增强,并且减少了抗菌药物的使用需求。
具体来说,在 PRRSV 和 PCV2 共感染之前进行 FMT 处理,死亡率降低了 70%,胃肠外抗菌治疗减少了 60%。另外,FMT 组的肺损伤严重程度显著降低。
这项研究表明,通过 FMT 调节肠道菌群对预防猪的呼吸系统感染有显著效果(niederwerder等人,2018)。
低估的收益
以上这些研究为利用肠道菌群来预防猪的呼吸系统感染提供了一个非常好的应用前景。通过调节肠道菌群来进行疾病控制这种抗生素替代策略,对于与人类健康息息相关的食品动物生产中的卫生保健至关重要。
我们的研究课题将肠道菌群多样性、有益菌暴露与改善感染性呼吸疾病转归联系在一起。通过 FMT 的方式,可以有效利用高生产性能个体的有益特性来提高猪群健康,这可能是一个被低估了的应用机会(Niederwerder,2018)。
原文链接: www.nationalhogfarmer.com/animal-health/using-gut-microbes-respiratory-relief
参考文献
- Bakker, G.J., Nieuwdorp, M., 2017. Fecal Microbiota Transplantation: Therapeutic Potential for a Multitude of Diseases beyond Clostridium difficile. Microbiology spectrum 5.
- Bojanova, D.P., Bordenstein, S.R., 2016. Fecal Transplants: What Is Being Transferred? PLoS biology 14, e1002503.
- Clement, T., Singrey, A., Lawson, S., Okda, F., Nelson, J., Diel, D., Nelson, E.A., Christopher-Hennings, J., 2016. Measurement of neutralizing antibodies against porcine epidemic diarrhea virus in sow serum, colostrum, and milk samples and in piglet serum samples after feedback. Journal of Swine Health and Production 24, 147-153.
- Cohen, N.A., Maharshak, N., 2017. Novel Indications for Fecal Microbial Transplantation: Update and Review of the Literature. Digestive diseases and sciences 62, 1131-1145.
- Furmanski, S., Mor, T., 2017. First case report of fecal microbiota transplantation in a cat in Israel. Israel Journal of Veterinary Medicine 72, 35-41.
- Gough, E., Shaikh, H., Manges, A.R., 2011. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 53, 994-1002.
- Hamilton, M.J., Weingarden, A.R., Sadowsky, M.J., Khoruts, A., 2012. Standardized frozen preparation for transplantation of fecal microbiota for recurrent Clostridium difficile infection. The American journal of gastroenterology 107, 761-767.
- Holtkamp, D.J., Kliebenstein, J.B., Neumann, E.J., Zimmerman, J.J., Rotto, H.F., Yoder, T.K., Wang, C., Yeske, P.E., Mowrer, C.L., Haley, C.A., 2013. Assessment of the economic impact of porcine reproductive and respiratory syndrome virus on United States pork producers. Journal of Swine Health and Production 21, 72-84.
- Jasmin, B.H., Boston, R.C., Modesto, R.B., Schaer, T.P., 2011. Perioperative ruminal pH changes in domestic sheep (Ovis aries) housed in a biomedical research setting. Journal of the American Association for Laboratory Animal Science : JAALAS 50, 27-32.
- Messori, S., Trevisi, P., Simongiovanni, A., Priori, D., Bosi, P., 2013. Effect of susceptibility to enterotoxigenic Escherichia coli F4 and of dietary tryptophan on gut microbiota diversity observed in healthy young pigs. Veterinary microbiology 162, 173-179.
- Mullen, K.R., Yasuda, K., Divers, T.J., Weese, J.S. 2018. Equine faecal microbiota transplant: Current knowledge, proposed guidelines and future directions, 151-160.
- Niederwerder, M.C., 2017. Role of the microbiome in swine respiratory disease. Veterinary microbiology 209, 97-106.
- Niederwerder, M.C., 2018. Fecal microbiota transplantation as a tool to treat and reduce susceptibility to disease in animals. Veterinary immunology and immunopathology 206, 65-72.
- Niederwerder, M.C., Constance, L.A., Rowland, R.R.R., Abbas, W., Fernando, S.C., Potter, M.L., Sheahan, M.A., Burkey, T.E., Hesse, R.A., Cino-Ozuna, A.G., 2018. Fecal Microbiota Transplantation Is Associated With Reduced Morbidity and Mortality in Porcine Circovirus Associated Disease. Frontiers in microbiology 9, 1631.
- Niederwerder, M.C., Jaing, C.J., Thissen, J.B., Cino-Ozuna, A.G., McLoughlin, K.S., Rowland, R.R.R., 2016. Microbiome associations in pigs with the best and worst clinical outcomes following co-infection with porcine reproductive and respiratory syndrome virus and porcine circovirus type 2. Veterinary microbiology 188, 1-11.
- Ober, R.A., Thissen, J.B., Jaing, C.J., Cino-Ozuna, A.G., Rowland, R.R.R., Niederwerder, M.C., 2017. Increased microbiome diversity at the time of infection is associated with improved growth rates of pigs after co-infection with porcine reproductive and respiratory syndrome virus (PRRSV) and porcine circovirus type 2. Veterinary microbiology 208, 203-211.
- Pereira, G.Q., Gomes, L.A., Santos, I.S., Alfieri, A.F., Weese, J.S., Costa, M.C., 2018. Fecal microbiota transplantation in puppies with canine parvovirus infection. Journal of veterinary internal medicine 32, 707-711.
- Rager, K.D., George, L.W., House, J.K., DePeters, E.J., 2004. Evaluation of rumen transfaunation after surgical correction of left-sided displacement of the abomasum in cows. J Am Vet Med Assoc 225, 915-920.
- Rosshart, S.P., Vassallo, B.G., Angeletti, D., Hutchinson, D.S., Morgan, A.P., Takeda, K., Hickman, H.D., McCulloch, J.A., Badger, J.H., Ajami, N.J., Trinchieri, G., Pardo-Manuel de Villena, F., Yewdell, J.W., Rehermann, B., 2017. Wild Mouse Gut Microbiota Promotes Host Fitness and Improves Disease Resistance. Cell 171, 1015-1028.e1013.
- Schachtschneider, K.M., Yeoman, C.J., Isaacson, R.E., White, B.A., Schook, L.B., Pieters, M., 2013. Modulation of systemic immune responses through commensal gastrointestinal microbiota. PloS one 8, e53969.
- Schuijt, T.J., Lankelma, J.M., Scicluna, B.P., de Sousa e Melo, F., Roelofs, J.J., de Boer, J.D., Hoogendijk, A.J., de Beer, R., de Vos, A., Belzer, C., de Vos, W.M., van der Poll, T., Wiersinga, W.J., 2016. The gut microbiota plays a protective role in the host defense against pneumococcal pneumonia. Gut 65, 575-583.
- Sender, R., Fuchs, S., Milo, R., 2016. Revised Estimates for the Number of Human and Bacteria Cells in the Body.(Essay)(Report). PLoS biology 14, e1002533.
- Song, D., Peng, Q., Chen, Y., Zhou, X., Zhang, F., Li, A., Huang, D., Wu, Q., Ye, Y., He, H., Wang, L., Tang, Y., 2017. Altered Gut Microbiota Profiles in Sows and Neonatal Piglets Associated with Porcine Epidemic Diarrhea Virus Infection. Scientific reports 7, 17439.
- Vu, H.L.X., Pattnaik, A.K., Osorio, F.A., 2017. Strategies to broaden the cross-protective efficacy of vaccines against porcine reproductive and respiratory syndrome virus. Veterinary microbiology 206, 29-34.